Иммунотерапия поздних стадий раковых заболеваний
К сожалению, у большого количества пациентов рак диагностируют в поздних стадиях, когда появляются очевидные клинические признаки. К этому времени, как правило, уже имеются видимые или невидимые метастазы, которые являются главными причинами неудач в лечении, развития рецидивов, распространения опухоли и резкого сокращению продолжительности жизни.
Даже у пациентов с раком, выявленным на ранних стадиях, стандартная жёсткая схема традиционного лечения с использованием химио- и/или лучевой терапии не может решить главную проблему онкологии – предотвращение рецидивов.
Поэтому в течение последних десятилетий Национальный Институт Рака США (NCI) и другие авторитетные учреждения и учёные ищут новые методы, которые могли бы решить эти проблемы. В противораковой борьбе своими многообещающими результатами выделяется иммунотерапия (главным образом, применение противораковых вакцин). Единственная вещь, сдерживающая распространение иммунотерапии – фактор времени. Требуется минимум 10-15 лет, прежде чем любая новая вакцина и метод лечения может появиться на фармацевтическом рынке как средство стандартной терапии.
Противоопухолевая вакцина РЕСАН может быть использована для воздействия на раковые образования поздних стадий, мобилизуя противораковый иммунотерапевтический потенциал. Для этого мы разработали два главных подхода, включающие самые последние иммунотерапевтические методы – экстракорпоральная активация противораковых иммунокомпетентных клеток (EAAIC) и комплексная иммунотерапия рака.
Комплексная иммунотерапия злокачественных опухолей
В организме существует сетевая иммунологическая защита, то есть функции одних иммунокомпетентных клеток частично перекрываются другими, благодаря чему система работает устойчиво. Развитие злокачественной опухоли указывает на прорыв сетевой защиты. Поэтому для лечения злокачественных опухолей необходимо использовать комплексную иммунотерапию.
Она включает:
1) максимальное удаление первичной опухоли и видимых метастазов;
2) применение противораковой вакцины;
3) использование цитокинов;
4) использование тироксина;
5) дезинтоксикационную терапию.
Вакцина вводится за 7-12 дней до операции, что наиболее предпочтительно, или через 7-14 дней после операции. Если в эти сроки ввести вакцину не удалось, её можно вводить и позже, но чем раньше введена вакцина, тем лучше результаты иммунотерапии.
Важным условием успешного применения вакцины является состояние системы иммунитета больного. Если ориентироваться на общий анализ крови, то вакцину целесообразно применять тогда, когда уровень лейкоцитов в периферической крови натощак не ниже 4,5X109 в л, а процент лимфоцитов – не менее 18. Если ориентироваться на результаты иммунного статуса, то количество CD4 лимфоцитов должно быть не менее 350 в 1 мкл, а количество CD8 лимфоцитов не менее 280 в 1 мкл периферической крови.
Важным этапом комплексной иммунотерапии является применение цитокинов. Дозы и кратность введения цитокинов зависят от состояния системы иммунитета и времени применения вакцины.
Интерлейкин-1α (ИЛ-1α) усиливает сниженный противоопухолевый иммунитет, замедляет рост опухоли и снижает её метастатический потенциал. ИЛ-1α необходимо применять до введения вакцины, если CD4
ИЛ-1α в данном случае необходимо вводить ежедневно, 5 дней, внутривенно, капельно в течение 30-40 минут, в дозе 15 нг на кг веса.
После улучшения показателей иммунного статуса вводят вакцину. После введения вакцины проводят курсы поддерживающей иммунотерапии ИЛ-1α в течение 6-12 месяцев. Поддерживающий курс проводят 1 раз в 2 месяца, он состоит из двух ежедневных введений в дозе 15 нг на кг веса, даже если количество CD4>350, а CD8>280. Если количество лимфоцитов снизилось ниже указанных границ (CD4
Интерлейкин-2 (ИЛ-2) применяют через 10-14 суток после введения вакцины в дозе 100000-125000 МЕ на м2 поверхности тела в день, внутривенно капельно, в течение 4 часов. Курс лечения состоит из 15-60 введений. Затем проводят поддерживающую иммунотерапию ИЛ-2 в течение 6-12 месяцев, с интервалом 2 месяца. ИЛ-2 вводят ежедневно, 4 дня, в дозе 125000 МЕ на м2.
Гамма-интерферон (ИФН-γ) применяется по следующей схеме: внутримышечное введение 1000000 МЕ ИФН-γ через день – 1 месяц, затем 2 месяца – 1 раз в неделю.
Гамма-интерферон начинают вводить через день после инъекций вакцины РЕСАН.
Если есть возможность во время основного курса иммунотерапии доставлять ИЛ-2 и ИФН-γ непосредственно к опухоли, то это наиболее предпочтительный вариант.
Обязательным условием комплексной иммунотерапии является применение L-тироксина. Его принимают по 25 мкг, под язык, утром, ежедневно в течение 4-6 месяцев. Затем его медленно отменяют, снимая по 25 мкг (один приём) в неделю.
Дезинтоксикационную терапию проводят с использованием энтеральных, а при необходимости и парэнтеральных препаратов.
Часто иммунотерапию приходится проводить после курсов химио и лучевой терапии, когда система иммунитета находится в подавленном состоянии. В этом случае необходимо использовать ДЕЗОКСИНАТ. Дезоксинат может применяться и профилактически перед началом цикла химио и лучевого лечения, особенно повторного, в ходе его или после его окончания. Показанием для профилактического применения препарата является наличие лейкопенического и тромбоцитопенического фона до начала химио- или лучевой терапии (лейкоциты менее 3,5·109/л, тромбоциты менее 150·109/л, соответственно), выраженная лейко и тромбоцитопения, развившаяся при предыдущем цикле химио или лучевой терапии (2,5·109/л и 100·109/л, соответственно). В случае лейкопении и/или тромбоцитопении, возникших в период проведения курса химио и лучевой терапии или после его окончания, показаниями к назначению дезоксината служит снижение содержания лейкоцитов в периферической крови до 2,0·109/л, тромбоцитов - 100·109/л и менее.
Сначала применяют однократное введение 0,5% раствора, внутримышечно или подкожно, в объёме 15 мл (лучше вводить в 3 точки по 5 мл). Затем дезоксинат вводят по 5 мл 1 раз в 3 дня, делая 10 таких инъекций. После этого - перерыв 1 месяц, а далее вводят дезоксинат по 5 мл 1 раз в неделю, делая 7 таких инъекций.
Предупреждение и лечение кахексии
При наблюдении за онкологическим больным необходимо проводить регулярное взвешивание (1 раз в 2 месяца), так как у 50-80% больных с прогрессирущим раком развивается кахексия. На неё указывает потеря более 5% веса от исходного (преморбидного - premorbid), в пределах шестимесячного периода. Кахексия – слово греческого происхождения, состоящее из двух слов: "kakos" – плохой и "hexis"– состояние. Развитие кахексии указывает на неблагоприятный прогноз и значительное ухудшение качества жизни.
Кахексия является главной причиной смерти больных раком. Она является следствим гиперметаболизма, характерного для многих больных раком. Клиническими проявлениями гиперметаболизма могут быть усталость, апатия (apathy), депрессия. Изменения затрагивают белковый, жировой, углеводный и энергетический обмен.
Для предотвращения развития и лечения кахексии назначают:
1) перитол (Cyproheptadinum) по 4 мг 4 раза в день, ежедневно, постоянно.
2) дексаметазон (Dexamethasonum) по 4 мг 1 раз в день, ежедневно, в течение 1 недели. Предпочтительнее принимать дексаметазон утром во время завтрака. Если отмечается улучшение аппетита, то дексаметазон принимают постоянно, а если аппетит не улучшился, дексаметазон отменяют и назначают Medroxyprogesterone в дозе 500 мг 2 раза в день. Если Medroxyprogesterone отсутствует, можно назначить Megestrol acetate по 40 мг 4 раза в день. При отсутствии эффекта дозу препарата увеличивают в 2 раза (по 80 мг 4 раза в день), при отсутствии эффекта от такой дозы переходят на приём препарата по 100 мг 4 раза в день. Если аппетит не улучшается, назначают Megestrol acetate по 200 мг 4 раза в день.
3) ибупрофен (Ibuprofenum) по 400 мг, 3 раза в день, ежедневно или индометацин (Indomethacinum) по 50 мг, 2 раза в день, ежедневно.
4) альмагель по 1 чайной ложке за 30-20 минут до приёма ибупрофена или индометацина.
5) активированный уголь по 2 грамма на ночь, ежедневно.
6) рыбий жир по 1 чайной ложке в неделю.
Применение вакцины РЕСАН приводит к стойкому, длительному повышению функциональной активности натуральных киллеров – CD56-позитивных лимфоцитов. Увеличивается их цитотоксическая активность и продукция β-эндорфина. β-эндорфин обладает выраженным обезболивающим и седативным действиями, повышение его уровня после вакцинации предотвращает развитие болевого синдрома или замедляет прогрессирование боли у большинства пациентов.
Экстракорпоральная активация противораковых иммунокомпетентных клеток
Перспективным направлением иммунотерапии поздних стадий раковых образований является экстракорпоральная (вне организма) активация вакциной РЕСАН иммунокомпетентных клеток крови и использование продуктов этой активации для лечения.
В результате активации лейкоцитов можно получать собственные цитокины ранней фазы иммунного ответа конкретного пациента и возвращать их обратно в оптимальных, физиологически сбалансированных соотношениях. Благодаря тому, что эти цитокины собственные и они не являются чужеродными, против них не образуются антитела, в отличие от введения рекомбинантных цитокинов, и поэтому активность собственных цитокинов сохраняется постоянно высокой, повышая эффективность проводимой иммунотерапии.
Получение цитокинов ранней фазы иммунного ответа
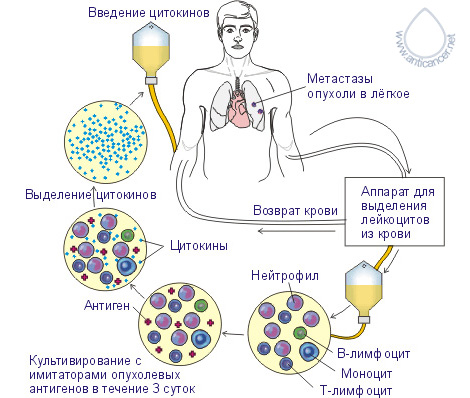
Рис. 1
Используя вакцину для экстракорпоральной активации лимфоцитов, можно провести селекцию клонов лимфоцитов, активных против конкретной опухоли пациента. Затем эти высокоактивные лимфоциты размножают и возвращают их обратно пациенту, значительно повысив тем самым противоопухолевый иммунный ответ.
Эти два метода можно использовать как самостоятельно, так и вместе. Они могут проводиться только в клиниках, оснащённых специальным оборудованием для сепарации клеток крови и работы с культурой клеток.
Получение противоопухолевых Т-лимфоцитов

Рис. 2