Иммунотерапия мастопатий и рака груди
 Что такое мастопатия и рак груди?
Что такое мастопатия и рак груди?
Мастопатия
Согласно определению ВОЗ (1984), мастопатия — это фиброзно-кистозная болезнь (ФКБ), характеризующаяся нарушением соотношений эпителиального и соединительно-тканного компонентов, широким спектром пролиферативных и регрессивных изменений тканей молочной железы.
По данным гистологических исследований молочных желез женщин возраста 20-40 лет, умерших по различным причинам, дисгормональные изменения обнаруживаются в 60-80% случаев. В 30-40% случаев мастопатия (дисгормональная гиперплазия молочной железы) обнаруживается при пальпации молочных желез.
ФКБ является доброкачественным заболеванием. Однако в ряде случаев данная патология может явиться промежуточной стадией в развитии злокачественного процесса. Поскольку доброкачественные заболевания и рак молочных желез имеют много общего в этиологических факторах и патогенетических механизмах, факторы риска развития мастопатий и рака молочных желез во многом идентичны. На сегодняшний день не выявлено ни одного специфического фактора риска развития этой патологии, поскольку мастопатия — мультифакторное заболевание, связанное как с генетическими факторами, так и с факторами окружающей среды.
В возникновении и развитии дисгормональных заболеваний молочных желез огромную роль играет состояние гипоталамо-гипофизарной системы. Нарушение нейрогуморальной составляющей репродуктивного цикла ведет к активации пролиферативных процессов в гормональнозависимых органах, в том числе и в тканях молочных желез, которые являются мишенью для стероидных гормонов яичников, пролактина, плацентарных гормонов и опосредованно гормонов других эндокринных желез организма. Эстрогены в большей степени влияют на пролиферацию эпителия ацинусов, дольковых и междольковых протоков, тогда как андрогены в большей степени влияют на степень выраженности фиброза [1, 2].
Большинство женщин не придают мастопатии большого значения, т.к. это заболевание не кажется им достаточно серьезным. На самом деле дисгормональная гиперплазия способна нанести здоровью женщины значительный урон, и во многих случаях при отсутствии должного лечения фиброзные узлы могут стать злокачественными (Рис. 1).
Неизмененная ткань молочной железы![]()
Гиперплазия (увеличение количества клеток)
![]()
Атипичная гиперплазия (аномальное увеличение
количества клеток, маркер рака молочной железы)![]()
Карцинома in situ (раковая опухоль не выходит за
границы протоков или долек, в которых она зародилась)
![]()
Инвазивный рак (раковая опухоль вышла за
границы протоков или долек, в которых она зародилась)

Рис. 1. Различные стадии патологических изменений молочной железы
Важность атипической гиперплазии как биологического маркера повышенного риска развития инвазивного рака груди была подтверждена в многоцентровом исследовании с участием более 280 000женщин [3]. Хотя мастопатия (mastos – молочная железа, pathy - заболевание) – это собирательный термин, охватывающий все патологические изменения в молочной железе, мы рассматриваем здесь главным образом дисгормональную гиперплазию молочной железы (фиброкистозные изменения). Это одно из наиболее распространенных доброкачественных заболеваний: примерно у 50% женщин при пальпации можно обнаружить неоднородность груди, циклические боли и болезненность при пальпации.
Фиброкистозные изменения наблюдаются в виде трех различных форм:
1.Гиперплазия протоков и формирование кист.
2.Аденоз (дольковая гиперплазия) и склерозирующий аденоз.
3.Фиброз.
На основании этих структурных изменений дисгормональная гиперплазия молочных желез классифицируется следующим образом [3, 4]:
1. Узловатая форма.
А) Аденофибромы.
Б) Фиброаденомы.
2. Диффузная форма.
А) Аденозы.
Б) Аденофиброматозы.
В) Фиброаденоматозы:
1) дольковый,
2) протоковый,
3) фиброзный,
4) кистозный,
5) пролиферативный:
а) аденоматозного характера,
б) папиллярного характера,
в) солидного характера.
Рак молочной железы
Рак молочной железы развивается, когда клетки молочной железы приобретают способность к бесконтрольному росту и проникают в близлежащие ткани или распространяются по всему телу. Теоретически рак может развиться из каждого вида ткани молочной железы, но обычно в патологический процесс вовлекаются либо протоки, либо железистая ткань.
Рак груди среди всех злокачественных опухолей у женщин встречается наиболее часто.
Первый пик заболеваемости приходится на репродуктивный период от 30 до 40 лет. По данным статистики, число заболевших за этот период составляет 80-100 на100 000женщин. В последующие годы жизни отмечается увеличение частоты рака молочных желез, в частности, если в 50 лет регистрируется 180 случаев, то после 65 лет – 250 случаев на100 000 женщин.
По данным ВОЗ, раком молочных желез ежегодно заболевает около 750 тыс. женщин, и именно это заболевание является главной причиной смертности женщин в возрасте от 40 до 55 лет [5].
Основными факторами риска развития рака груди являются семейный анамнез рака груди для родственников первой степени, наличие в анамнезе доброкачественных заболеваний молочной железы, возраст старше 40 лет, поздний возраст при рождении первого ребенка или бездетность. Заместительная терапия эстрогенами или прием гормональных таблетированных контрацептивов также в некоторой степени увеличивает риск развития рака груди, как и радиоактивное облучение и употребление алкогольных напитков. Курение увеличивает риск метастазов рака молочной железы в легкие [6, 7]. В настоящее время общепризнанно, что рак молочной железы встречается в 3-5 раз чаще на фоне доброкачественных заболеваний молочных желез и в 30-40 раз чаще при узловых формах мастопатии с явлениями пролиферации эпителия молочных желез. Считается, что 10-15% случаев рака груди являются наследственными [8]. Изменения от обычной клетки до канцероматозной происходят под влиянием определенных генных мутаций. Эти изменения наиболее часто обнаруживают в генах BRCA1 и BRCA2 (BReast CAncer Gene 1 – ген рака груди 1 и BReast CAncer Gene 2 – ген рака груди 2) (Рис. 2).


Рис. 2. Гены, в которых обнаруживают мутации при раке груди
Мутации в BRCA1 обнаруживают примерно в 45% случаях наследственного рака, а BRCA2 – еще в 35%. Эти гены присутствуют как у мужчин, так и у женщин, поэтому изменения могут передаваться по наследству как от матери, так и от отца. Мужчины-носители BRCA2 также относятся к группе повышенного риска развития рака груди [9].
Классификация рака груди, предложенная Американским комитетом по злокачественным опухолям:
Стадия 0: самый ранний рак молочной железы. Раковая опухоль не распространяется за пределы протоков (дуктальная карцинома in situ) или долек (лобулярная карцинома in situ или лобулярная неоплазия).
Стадия I: размер опухоли не более 2 см в диаметре при отсутствии поражения лимфатических узлов или каких-либо других тканей.
Стадия II: размер опухоли от 2 до 5 см в диаметре и/или метастазы
обнаруживают в 1-3-х подмышечных лимфатических узлах на стороне поражения груди. Этой стадии также соответствует опухоль размером более 5 см в диаметре без поражения лимфатических узлов.
Стадия III: опухоль менее 5 см в диаметре и поражение от 4 до 9 подмышечных лимфоузлов, или опухоль более 5 см в диаметре и поражение от 1 до 9 подмышечных лимфоузлов, или локальное распространение опухоли (на близлежащие органы и ткани), обычно с вовлечением кожи или грудной стенки и поражение от 0 до 9 подмышечных лимфоузлов. При стадии 3 метастазы в отдаленные органы и лимфоузлы отсутствуют.
Стадия IV: опухоль вне зависимости от её размеров метастазирует в отдаленные органы, часто поражая кости, легкие, печень или мозг; поражаются и отдаленные лимфоузлы.
Воспалительный рак молочной железы – разновидность инфильтративной дуктальной карциномы. Название дано в соответствии с типичной клинической картиной. Появляется припухлость груди и ее покраснение, кожа становится теплой на ощупь и уплотняется, т. е. молочная железа выглядит инфицированной. Это происходит из-за быстрого роста раковой опухоли и блокады лимфатических протоков молочной железы. В 90% случаев в момент диагностики воспалительного рака молочной железы злокачественные клетки уже начали распространяться по лимфатическим путям. Прогноз для этой разновидности рака груди наименее благоприятный, но и встречается он относительно редко.
Обследование по поводу узловых образований груди должно включать физикальный (врачебный) осмотр, маммографию, аспирационную биопсию и некоторые специфические лабораторные исследования (определение рецепторов к эстрогенам и прогестерону, гиперэкспрессии HER2).
Для ранней диагностики мастопатии и рака молочной железы обычно достаточно следующих скрининговых методов: регулярной пальпации женщиной своих молочных желез, ежегодных маммографии и осмотра гинеколога.
Общепринятые методы лечения мастопатии
Единого алгоритма, пригодного для лечения всех случаев мастопатии, не существует. В каждом конкретном случае лечение должно быть строго индивидуальным, хотя можно выделить основные направления:
- Гормональные методы лечения.
- Негормональные консервативные методы лечения.
- Хирургические методы лечения.
Гормональные методы лечения
Как было указано выше, рост и пролиферация различных тканей молочной железы находятся под контролем эстрогенов, прогестерона, пролактина, гормона роста, андрогенов, тироксина и т.д. Однако гормональная терапия направлена главным образом на коррекцию влияния на ткани молочной железы эстрогенов [10, 11].
Антиэстрогены – тамоксифен [12], торемифен, ингибиторы ароматазы – наиболее часто применяемые препараты, эффективные как в отношении лечения мастопатии, так и снижающие риск развития рака [11, 13, 14].
Пероральные контрацептивы – при приеме этих препаратов достигается не только контроль за овуляцией, но и уменьшение синтеза эндометрием рецепторов к эстрогенам и достижение баланса между резкими гормональными изменениями в течение менструального цикла. Выбранный контрацептивный препарат должен иметь низкое содержание эстрогенов и высокое – гестагенов. Отрицательным моментом назначения пероральных контрацептивов является то, что клинический эффект в отношении мастопатии развивается нескоро – через 1-2 года после начала приема. Лечение мастопатии гестагенами оказывается эффективным в двух случаях из трех.
Производные тестостерона (линестринол, норгестрил, даназол) применяются чаще, чем производные прогестерона (медроксипрогестерона ацетат).
Ингибиторы секреции пролактина – препараты, подобные бромкриптину – эффективны в лечении мастопатий у пациенток с повышенным уровнем тиротропин-релизинг гормона.
Агонисты релизинг-фактора лютеинизирующего гормона (luteinizing hormone-releasing hormone – LHRH). Эти препараты вызывают торможение действия сывороточных эстрогена и тестостерона. В связи с выраженными побочными эффектами аналоги LHRH назначают в основном пациенткам с наиболее тяжелыми формами мастопатии, при выраженной мастодинии (боли в груди), когда отсутствует эффект от лечения другими гормонами.
Важное замечание: При развитии мастопатии на фоне заместительной гормональной терапии дополнительное назначение гормонов может ухудшить течение заболевания.
Следует учитывать, что пролиферативные формы фиброаденоматоза, а также фиброзно-кистозные или фиброматозные мастопатии плохо поддаются гормональной терапии, которая в то же время сопровождается выраженными побочными эффектами.
Негормональные консервативные методы лечения
Кроме гормонального дисбаланса, у пациенток, страдающих мастопатией, отмечены патологические изменения со стороны лимбической системы, ретикулярной формации и метаболических процессов. Таким образом, имеет смысл вводить в состав комплексной терапии витамины (A, C, E и B), седативные и психотропные средства, диуретики, периферические вазодилататоры, нестероидные противовоспалительные препараты. Следует также обратить внимание на характер питания и выбирать удобные бюстгалтеры.
К сожалению, традиционный консервативный путь лечения мастопатии не решает самой важной проблемы — профилактики рака груди, так как далеко не всегда даже при тщательном наблюдении врачам удается вовремя заметить перерождение мастопатии в рак, а за полгода – год процесс нередко становится необратимым.
Хирургическое лечение
Тонкоигольная аспирация – наиболее щадящий метод: внутрь кисты вводят иглу и отсасывают ее содержимое. Часто эту манипуляцию выполняют в диагностических целях, но для больших кист она приобретает лечебное значение.
Чаще всего выполняют иссечение узлов по мере их обнаружения.
Однако последнее время к оперативному лечению мастопатии стали относиться осторожнее, поскольку операция не устраняет причину заболевания. У многих женщин, перенесших по10-15 операций, после каждого оперативного вмешательства узлы появлялись вновь, располагаясь вдоль хирургического шва, как гроздья винограда.
Общепринятые методы лечения рака молочной железы
В настоящее время существует ряд общепринятых методов лечения рака молочной железы: хирургический, химиотерапия, лучевая терапия и гормональное лечение [11, 13, 14, 15, 16].
Хирургическое лечение в зависимости от стадии заболевания заключается в частичной или радикальной мастэктомии, причем часто операцию необходимо комбинировать с химиотерапией или лучевой терапией.
В рамках гормональной терапии применяют тамоксифен (при сохраненном нормальном эстрогенном фоне) и ингибиторы ароматазы (в период менопаузы).
Выбор того или иного метода лечения зависит от стадии заболевания и гистологической характеристики опухоли.
Необходимость нового подхода к лечению мастопатии и рака молочной железы
Приведенные выше общепринятые методы лечения мастопатий и злокачественных опухолей молочной железы эффективны далеко не во всех случаях, к тому же их применение часто сопровождается существенными отрицательными побочными эффектами. Даже оперативное лечение, которое является наиболее радикальным методом, сопровождаясь обычным хирургическим риском и оставляя после себя косметический дефект, не способно полностью победить болезнь – процент послеоперационных рецидивов достаточно высок. Проблема метастазирования и рецидивирования не может быть решена традиционными методами.
Гормональное лечение патологии молочной железы также имеет свои недостатки. Прием наиболее часто назначаемого препарата – такмоксифена – вызывает уменьшение размеров новообразований и снижает риск развития их рецидивов, но при этом повышается вероятность гиперплазии и рака эндометрия, венозной тромбоэмболии, катаракты, а в некоторых случаях – такмоксифен-зависимых форм рака молочной железы. В настоящее время проводятся клинические испытания селективных модуляторов эстрогеновых рецепторов (selective estrogen receptor modulators - SERM), такие как ралоксифен, лишенных побочных эффектов тамоксифена.
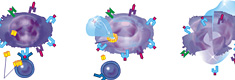
Одним из ярких представителей новаторских препаратов является герцептин (трастузумаб). Герцептин уникален тем, что его действие избирательно направлено на подавление рецептора HER2, который часто присутствует на поверхности клеток рака молочной железы [17]. Герцептин – моноклональные антитела, которые находят эти рецепторы на клетках и блокируют их. После того как герцептин заблокировал HER2-рецепторы на поверхности раковой клетки, ее дальнейший рост прекращается, а в ряде случаев наблюдается уменьшение опухоли. Кроме того, герцептин обладает дополнительным механизмом противоопухолевого действия, поскольку является мощным медиатором антител-зависимой цитотоксичности.
К сожалению, герцептин потенциально может быть эффективен лишь в 25% случаев рака груди (именно такова частота злокачественных опухолей молочной железы, гиперэкспрессирующих протеин HER2). Кроме того, препарат обусловливает многочисленные побочные эффекты, включая кардиотоксичность и возникающую вследствие этого сердечную недостаточность.
Другим новаторским препаратом является кселода (капецитабин). Кселода сама по себе не обладает способностью убивать раковые клетки, сначала это соединение должно пройти три этапа превращений в организме человека (18). Последний этап превращений, в результате которого и образуется конечный продукт с цитотоксической активностью, проходит в раковой опухоли. Таким образом, раковая опухоль превращается в "фабрику" по производству яда против самой себя. Это не только увеличивает эффективность действия препарата, но и снижает общее неблагоприятное воздействие на организм в целом. Эти уникальные качества кселоды позволяют говорить о совершенно новом классе противораковых препаратов, которым дано название "туморактивируемых". В настоящее время кселода является первым и пока единственным представителем этого прогрессивного класса лекарств.
В последнее время все больше онкологов приходит к выводу, что именно коррекция нарушений со стороны системы иммунитета является ключевым моментом в успешной борьбе с раком [19, 20, 21, 22, 23, 24].
При раке молочной железы повышен уровень гиперэкспрессии маммаглобина А, причем экспрессия ограничена эпителием молочной железы и метастатическими опухолями груди. Таким образом, специфическая иммунотерапия, направленная против маммоглобина А, может стать важным направлением в лечении и предотвращении рака груди [25, 26].
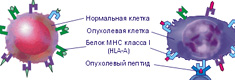
Иммунный надзор над злокачественными клетками может осуществляться путем взаимодействия компонентов системы иммунитета с экспрессированным на поверхности клеток рака груди антигеном MHC II, в норме отсутствующим [27].
С помощью нового метода – проточной цитометрии – было изучено влияние противоопулевой вакцинации на антигенспецифичный Т-клеточный иммунитет у пациенток со злокачественными опухолями груди [28]. Полученные данные свидетельствуют об эффективности противоопухолевой вакцинации.
Таким образом, очевидно, что идеальное средство для лечения патологических состояний молочной железы, особенно мастопатий и злокачественных опухолей, должно обладать следующими свойствами:
- способностью предотвращать развитие заболеваний;
- возможностью решить проблемы метастазирования и рецидивирования;
- не вызвать существенных побочных эффектов.
Противоопухолевые вакцины – новое направление в лечении злокачественных заболеваний, клинические испытания которых демонстрируют многообещающие результаты как в профилактике, так и в лечении рака груди [29, 30, 31, 32].
Противоопухолевая вакцина РЕСАН – один из этих новых препаратов.
Действие вакцины РЕСАН при патологических состояниях молочной железы
В состав вакцины входят гликопротеины, которые сходны с фрагментами опухольассоциированных антигенов, связанных с клетками рака молочной железы:
1. Ovarian carcinoma antigen CA125 (1A1-3B) (KIAA0049)
2. MUCIN 1 (TUMOR-ASSOCIATED MUCIN)
3. BREAST CARCINOMA- ASSOCIATED ANTIGEN DF3.
4. Cancer associated surface antigen.
5. Adenocarcinoma antigen ART1.
6. Serologically defined breast cancer antigen NY-BR-15.
7. Serologically defined breast cancer antigen NY-BR-16.
8. CA 19-9
Гликопротеины, входящие в состав вакцины, имитируют от 6 до 50 фрагментов (длиной 7-30 аминокислотных остатков) каждого из указанных опухолевых антигенов.
По данным ряда авторов, такие онкомаркеры, как раково-эмбриональный антиген (РЭА), высокомолекулярные антигены СА 125 и СА 19-9, муциноподобный раково-ассоциированный антиген (МРА) позволяют осуществлять мониторинг эффективности проводимого лечения [33, 34].
Таким образом, РЕСАН – противоопухолевая вакцина, которая благодаря своим ксеногенным свойствам способствует формированию адекватного специфического противоопухолевого иммунного ответа, являясь эффективным средством профилактики и лечения мастопатий и злокачественных опухолей молочной железы.
Заключение
Несмотря на огромное количество исследований, проводимых в этой области, во всем мире по-прежнему наблюдается рост заболеваемости раком груди. Одной из наиболее распространенных болезней, потенциально опасных в отношении развития рака груди, является дисгормональная гиперплазия молочных желез. Общепринятых средств для профилактики этих заболеваний в настоящее время не существует, а традиционные методы лечения, к сожалению, недостаточно эффективны. В то же время применение вакцины РЕСАН с её широким спектром противоопухолевого действия демонстрирует очевидные преимущества по сравнению со стандартными методами лечения:
1. РЕСАН можно использовать для предотвращения указанных заболеваний, особенно при наличии наследственной предрасположенности (рака груди у родственниц), или для профилактики озлокачествления доброкачественных образований молочной железы.
2. Вакцину можно использовать в сочетании с хирургическими методами лечения (см. Наиболее рациональное применение вакцины РЕСАН при лечении злокачественных опухолей) для уничтожения метастазов небольших размеров и предотвращения рецидивов рака груди после оперативного вмешательства, что может привести к полному излечению опухоли.
3. Вакцинотерапию можно комбинировать с гормональной терапией или биотерапией (например, герцептином) для увеличения суммарного терапевтического эффекта, сведения к минимуму побочных эффектов и снижения дозы гормональных препаратов.
4. Применение РЕСАНа может значительно уменьшить болевой синдром и общее состояние у пациенток с поздними стадиями рака груди и наиболее агрессивными злокачественными опухолями.
5. Вакцинотерапия РЕСАН не сопровождается существенными побочными эффектами.
Вакцина РЕСАН способна изменить устоявшиеся представления врачей и пациентов о лечении рака, которое до сих пор ассоциируется с выпадением волос, угнетением функции кроветворной системы и связанными с этим другими осложнениями.
Информационные источники
1.Grio R., Cellura A., Germao R. et al. // Minerva Girncolegica. 1998. Vol. 50 N3. P. 101-103.
2.Kotller M. L., Stwrzec A., Carre M. C. et al. // Int J Cancer. 1997. Vol. 71. N 4. P. 595-599.
3.Online management of breast diseases, Benign Breast Lesions. TransMed Network
4.Диагностика заболеваний молочных желез В. Н. Серов, Т. Т. Тагиева, В. Н. Прилепская Научный центр акушерства, гинекологии и перинатологии (дир.-акад. РАМН В. И. Кулаков). Интерактивно.
5.Сидоренко Л. Н. Молочная железа. Как уберечь себя от рака. 1998.
6.Armstrong, K., Eisen, A., & Weber, B. (2000) Primary Care: Assessing the Risk of Breast Cancer. The New England Journal of Medicine, 342(8), 564-571. Goldhirsch, A., Glick, J.H., Gelber, R.D., Coates, A.S., Senn, H-J. (2001)
7.Breast Cancer Risk Factors. Интерактивно.
8.Weiss MC, Fowble BL, Solin LJ, et al.: Outcome of conservative therapy for invasive breast cancer by histologic subtype. Int J Radiat Oncol Biol Phys 23 (5): 941-7, 1992. [PUBMED Abstract]
9.Wazer DE, Schmidt-Ullrich RK, Schmid CH, et al.: The value of breast lumpectomy margin assessment as a predictor of residual tumor burden. Int J Radiat Oncol Biol Phys 38 (2): 291-9, 1997. [PUBMED Abstract]
10.Консервативное лечение фиброзно-кистозной болезни молочной железы (мастопатии)
Д. Балтиня, А. Сребный Латвийский научно-исследовательский институт клинической и экспериментальной медицины, Рига (Латвия).
11.Keshelava V.V. // New treatment and diagnostic means in oncology. International Medical Journal 5' 2000 p. 457-459.
12.The use of Tamoxifen (Breast Cancer Drug) is Questioned in Dutch Study because of a higher incidence of Endometrial Cancer. By Denise Grady не находит страницу
13.Selective estrogen receptor modulation: the search for an ideal hormonal therapy for breast cancer.
Dhingra K.Hoffmann-La Roche, Inc., Nutley, New Jersey 07110, USA. Cancer Invest 2001;19(6):649-59
14.Oncolinks. Breast Cancer: The Basics. Christopher Dolinsky, MSIV The University of Pennsylvania Cancer Center, May 29, 2002.
15.Meeting Highlights: International Consensus Panel on the Treatment of Primary Breast Cancer. Journal of Clinical Oncology, 19(18), 3817-3827.
16.Hortobagyi, G.N., (1998) Drug Therapy: Treatment of Breast Cancer. The New England Journal of Medicine, 339(14), 974-984.
17.Herceptin® (Trastuzumab). Genentech, Inc.1 DNA Way South San Francisco, CA 94080-4990
18.XELODA® (capecitabine). Mechanism of Action.
19.Kruger, W. et al. Reverse transcriptase/polymerase chain reaction detection of cytokeratin-19 mRNA in bone marrow and blood of breast cancer patients. / J. Cancer Res. Clin. Oncol. 1996, 122 (11), 679-686. 16. Ethier, S. P. et al.
20.Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. / Cancer Res. 1993, 53 (3), 627-635.
21.Immunogenicity and immune response in breast cancer. Carasevici E. Department of Immunology, Faculty of Medicine, Gr. T. Popa University of Medicine and Pharmacy, Iasi, Romania. Roum Arch Microbiol Immunol 2001 Oct-Dec;60(4):285-96
22.Natural anti-Gal antibody as a universal augmenter of autologous tumor vaccine immunogenicity. Immunology Today. vol.18, No. 6, june 1997, pp. 281-285. Uri Galili and Denise C. LaTempl.
23.Tumor antigens recognized by T cells. Immunology Today. Thierry Boon, Pierre G. Coulie and Benoit Van den eyde. vol.18, No. 6, june 1997, pp. 267-268.
24.Analysis of endogenous peptides bound by soluble MHC class I molecules: a novel approach for identifying tumor-specific antigens. Eur J Immunol 2002 Jan;32(1):213-22. Barnea E, Beer I, Patoka R, Ziv T, Kessler O, Tzehoval E, Eisenbach L, Zavazava N, Admon A.The Smoler Protein Center, Department of Biology, Technion, Haifa, Israel.
25.Stress, coping, and immune function in breast cancer. Luecken LJ, Compas BE. Department of Psychology, Arizona State University, Tempe 85287, USA. Ann Behav Med 2002 Fall; 24(4):336-44.
26.Identification of HLA-A3-restricted CD8+ T cell epitopes derived from mammaglobin-A, a tumor-associated antigen of human breast cancer.
Jaramillo A, Majumder K, Manna PP, Fleming TP, Doherty G, Dipersio JF, Mohanakumar T. Department of Surgery, Washington University School of Medicine, St. Louis, MO, USA. Int J Cancer 2002 Dec 10;102(5):499-506.
27.Major histocompatibility complex class II antigen and costimulatory molecule expression on the surface of breast cancer cells. Fan P, Wang S, Liu X, Zhen L, Wu Z. Department of General Surgery, First Hospital, Nanjing Medical University, Nanjing 210029, China. Zhonghua Zhong Liu Za Zhi 2002 Jul;24(4):327-30.
28.Impact of high-dose chemotherapy on antigen-specific T cell immunity in breast cancer patients. Application of new flow cytometric method.
Svane IM, Nikolajsen K, Hansen SW, Kamby C, Nielsen DL, Johnsen HE. Department of Oncology, Herlev Hospital/University of Copenhagen, DK-2730 Herlev, Denmark. Bone Marrow Transplant 2002 Apr;29(8):659-66.
29.Pantel, K. et al. / Establishment of micrometastatic carcinoma cell lines: a novel source of tumor cell vaccines. / J. Natl. Cancer Inst. 1995, 87 (15), 1162-1168. 15.
30.The most important part in defeating cancer is a well working immune system... Интерактивно.
31.The present and future of cancer vaccines – a measured perspective... Интерактивно.
32.How to find current cancer vaccine clinical trials?
33.Vecchione A. New and old in prognosis determination. 1993, Nov-Dec, 7 (6B0. p.623-636).
34.Yasasever V., Karaloglu D., Erturk N. Diagnostic value of the tumor marcers in breast cancer. Eur. J. Gynaecol Oncol. 1994, 15(1), p. 33-36.