Иммунотерапия эндометриоза с помощью вакцины РЕСАН
Эндометриоз – заболевание, при котором клетки, в норме выстилающие полость матки, обнаруживаются и в других местах, обычно в пределах таза. Каждый месяц эта эктопическая ткань, находящаяся под гормональным контролем, подвергается таким же циклическим изменениям, как и весь эндометрий. Ежемесячные внутренние кровотечения не находят выхода из полости таза, приводя к развитию воспаления, болям и формированию соединительной ткани.
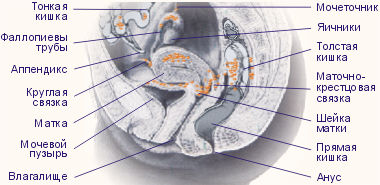
Рис. 1. Возможные варианты локализации эндометриоза
Термин "эндометриоз" древнегреческого происхождения: энд – внутри, метра – матка, озис – болезнь. По данным разных авторов, эндометриоз встречается у 6-44% женщин репродуктивного возраста [1]. Более того, эндометриоз обнаруживают в 30-40% случаев бесплодия у женщин [2, 3]. Узлы эндометрия ("эндометриомы") располагаются главным образом в области таза и яичников в виде либо небольших поверхностных "островков", либо эпителиальных "шоколадных" кист. Рост и прогрессирование эндометриом, как и эндометрия, подвержены цикличным изменениям под влиянием эстрогенов. Клинические симптомы эндометриоза – дисменоррея, боль во время полового сношения, боль в области малого таза или живота в период менструации. Одно из наиболее частых осложнений эндометриоза – бесплодие [3, 4]. В последние десятилетия также значительно возросло число злокачественных новообразований, развитию которых предшествовало появление эндометриоза.
Согласно рекомендациям Американского Общества Репродуктивной Медицины, эндометриоз классифицируется по стадиям:
Определение стадии эндометриоза основано на локализации, количестве, глубине и размере эндометриоидных разрастаний. Специфические критерии включают в себя:
- протяженность разрастаний;
- вовлечение в патологический процесс различных структур таза;
- протяженность спаечного процесса в тазу;
- наличие непроходимости фаллопиевых труб.
Стадия эндометриоза не всегда коррелирует со степенью болевого синдрома, риском бесплодия или наличием другой симптоматики. Например, вполне возможно наличие стойкого выраженного болевого синдрома у женщин с первой стадией эндометриоза и, напротив, асимптомное течение эндометриоза четвертой стадии. Восстановление фертильности на фоне лечения наиболее вероятно у пациенток с двумя первыми стадиями эндометриоза.
Эндометриоз является лишь гинекологическим проявлением системной патологии. Его можно сравнить с видимой верхушкой огромного айсберга проблем, в основе которых лежит дисрегуляция различных иммунных и гормональных процессов. Наряду с симптомами, традиционно связываемыми с заболеванием (дисменоррея, диспареуния и бесплодие), у этих женщин наблюдается высокая частота аллергических реакций, склонность к инфекциям, пролапс митрального клапана, синдром хронической усталости [5]. По данным Американской Ассоциации Эндометриоза, у женщин, страдающих эндометриозом, и у их родственниц повышен риск развития рака молочной железы, рака яичников, меланомы и не-ходжкинской лимфомы [6]. У больных эндометриозом женщин чаще встречаются аутоиммунный тиреоидит и дуффузно-токсический зоб [5]. Кроме того, в сочетании с эндометриозом чаще наблюдаются ревматоидный артрит, системная красная волчанка и системная склеродермия, что свидетельствует о ведущей роли нарушений системы иммунитета при этом заболевании.
Эндометриоз и система иммунитета
Эндометриоидные разрастания можно рассматривать как аналог опухолевых клеток с соответствующим неадекватным контролем со стороны системы иммунитета. Нормально функционирующая система иммунитета не позволяет клеткам эндометрия выживать где бы то ни было, кроме полости матки, и эффективно уничтожает эктопический эндометрий. У женщин, страдающих эндометриозом, наблюдается дисфункция системы иммунитета, что позволяет эктопическому эндометрию продолжать свой рост. Не подвергшиеся разрушению эктопические клетки эндометрия могут вызывать воспалительную реакцию, сопровождающуюся активацией макрофагов [7, 8]. Иммунологическое повреждение при эндометриозе связано с усиленным В-клеточным ответом и повышением уровня аутоантител. У женщин, страдающих эндометриозом, имеется снижение активности натуральных киллеров, приводящее к уменьшению цитотоксичности к собственному эктопически расположенному эндометрию.
Современный общепринятый подход к лечению эндометриоза
Лечение эндометриоза в каждом конкретном случае основано на:
- Данных анамнеза и наличии сопутствующих заболеваний.
- Клинической симптоматике.
- Стадии эндометриоза.
- Переносимости применяемых препаратов и немедикаментозных методов лечения.
- Отношения пациентки к возможной беременности.
Консервативное лечение эндометриоза можно разделить на несколько направлений:
- Назначение обезболивающих препаратов, таких как нестероидные противовоспалительные средства и анальгетики.
- Гормональная терапия: назначение агонистов гонадотропин-релизинг гормона, которые тормозят секрецию эстрогенов, создавая «медикаментозную менопаузу»; применение даназола, синтетического производного тестостерона; применение пероральных контрацептивов, в состав которых входят и эстрогены, и прогестины, предотвращающие овуляцию и уменьшающие менструальную кровопотерю.
Хирургические методы лечения эндометриоза включают:
- Лапароскопическое малоинвазивное вмешательство: лапароскоп вводят в полость таза через небольшой разрез в брюшной стенке и удаляют видимые эктопические эндометриоидные разрастания.
- Лапаротомию – более обширное хирургическое вмешательство, при котором эктопические эндометриоидные разрастания удаляют, стараясь как можно меньше травмировать неповрежденные ткани.
- Гистерэктомию – удаление матки (в некоторых случаях – с придатками).
Иногда используют сочетание нескольких методов, например, одновременно проводят гормональную терапию и лапароскопическое или лапаротомическое лечение.
Разрабатываемые направления консервативной терапии эндометриоза включают применение антагонистов гонадотропин-релизинг гормона.
Исследователи считают, что эта группа препаратов, в отличие от широко применяющихся в настоящее время агонистов гонадотропин-релизинг гормона, не вызывает такого широкого спектра побочных эффектов, превосходя их по силе действия.
Ингибиторы ароматазы – новое направление в лечении эндометриоза. Ранее эти препараты применяли только для лечения рака груди, сейчас их начинают применять и при эндометриозе.
Селективные модуляторы эстрогеновых рецепторов (SERMs – Selective Estrogen Receptor Modulators) обладают действием эстрогенов там, где это необходимо (в отношении сердечно-сосудистой и костно-мышечных систем), но позволяют избежать отрицательного влияния на ткани молочной железы и матки. Как было доказано в исследованиях на животных, применение SERMs предотвращает остеопороз и вызванную эстрогенами пролиферацию эндометрия. При использовании SERMs у макак резус, больных эндометриозом, наблюдалось уменьшение размеров матки и существенное уменьшение размеров эндометриоидных разрастаний.
Также изучается применение при эндометриозе селективных модуляторов прогестероновых рецепторов (Selective Progesterone Receptor Modulators – SPRMs). Эти препараты обладают высокой специфичностью к прогестероновым рецепторам, и ожидают, что длительное применение SPRMs будет способно уменьшить размеры очагов эндометриоза без отрицательных эффектов в отношении костной ткани.
Использование модуляторов внеклеточного матрикса (Extracellular Matrix Modulators – EMMs) также является предметом внимания исследователей. Пролиферирующий эндометрий секретирует специфические ферменты, а изоляция и разрушение этих ферментов с помощью EMMs может стать одним из наиболее перспективных направлений в лечении эндометриоза.
Тербуталин в настоящее время используют для предотвращения преждевременных родов, но также изучается эффективность этого препарата для купирования болевого синдрома при эндометриозе.
RU-486 (мифепристон) блокирует способность эндометрия пролиферировать в ответ на действие эстрогенов, что делает возможным применение препарата в качестве одного из методов гормонального лечения эндометриоза.
Ангиогенез представляется очень важной областью для исследований. Как известно, любая вновь образовавшаяся ткань (в случае эндометриоза – эктопические очаги роста эндометрия) требует дополнительного кровоснабжения. Без адекватного кровоснабжения гормональное влияние на эктопический эндометрий нивелируется. Следовательно, рост эндометриоидных разрастаний потенциально может быть остановлен путем нарушения их кровоснабжения. Препараты, замедляющие или прекращающие ангиогенез, могут также препятствовать образованию спаек.
Иммунотерапия эндометриоза
Современные традиционные методы лечения эндометриоза по своей природе либо хирургические, либо гормональные. Поскольку при эндометриозе задействованы иммунологические механизмы, нельзя ожидать, что хирургический подход может помочь излечить эту болезнь. Гормональный подход также не является ни этиологическим, ни патофизиологическим и обеспечивает лишь временный терапевтический эффект.
Исследования последних лет продемонстрировали наличие при эндометриозе множества иммунных нарушений, и уже можно с определенностью говорить, что именно дефект системы иммунитета приводит к этому заболеванию. Доказательством является выявление иммунологических дефектов при самых легких формах эндометриоза. Иммунологическая этиология и патофизиология эндометриоза предполагает эффективность иммунологического подхода к лечению этого заболевания.
Целью иммунотерапии эндометриоза является нормализация функции активированных натуральных киллеров, усиление Т-клеточного ответа против эктопически расположенного эндометрия.
Разработано совершенно новое направление лечения эндометриоза – иммунотерапия с использованием противоопухолевой вакцины РЕСАН, которая способствует формированию специфического клеточного иммунного ответа, направленного против эндометриом [23, 24].
Развитие эндометриом характеризуется высоким риском рецидивов и возможностью имплантации их клеток в удаленные от первичного очага места. Инвазия этих клеток в различные ткани указывает на то, что они имеют некоторые свойства, сходные со злокачественными опухолями яичников и матки. Показано, что с низкой гистологической дифференцировкой, повышенным риском локальной инвазии и метастазов коррелирует повышение экспрессии рецепторов факторов роста, опухольассоциированных антигенов CA125, CA15-3 и снижение экспрессии молекул клеточной адгезии – Е-катгеринов [28, 29, 30, 31]. Поскольку и опухоли яичников и матки, и эндометриоз объединяет нарушенный контроль за пролиферацией со стороны системы иммунитета, мы рекомендуем применение имитаторов опухолевых антигенов (вакцины РЕСАН) с целью коррекции системы иммунитета у больных эндометриозом.
Ниже приводится сокращенный вариант протокола применения вакцины РЕСАН у женщин с различной генитальной патологией.
Мы наблюдали 22 женщины, среди которых были 12 больных, страдающих генитальным эндометриозом – аденомиозом, позадишеечными формами эндометриоза, наружным генитальным эндометриозом, 10 больных – с сочетанными формами эндометриоза и миомы матки; у двух пациенток имелись кистозные образования яичников [22]. Ранее пациентки получали различное лечение, включающее гормонотерапию, курсы иммуномодуляторов, антиоксидантную терапию. Однако эффект от полученного лечения не был длительным, сроки ремиссии ограничивались 2-3 месяцами после окончания приема препаратов, причём улучшение касалось в основном клинической симптоматики (некоторое уменьшение болевого синдрома, незначительное улучшение общего состояния). В связи с кратковременным и недостаточно выраженным эффектом от предыдущей медикаментозной терапии мы проводили пациенткам курс иммунотерапии ксеногенной вакциной РЕСАН, которая имитировала эндометриозные и миомные антигены [24]. Всем наблюдаемым больным инъекции вакцины проводились внутрикожно однократно. Больные были обследованы до и после лечения. Болевой синдром оценивали в баллах по Mac Laverty:
боли в области таза, не связанные с половым актом или менструацией (3 балла – интенсивные, резкие, почти постоянные, больные были вынуждены принимать анальгетики; 2 балла – умеренные, терпимые, заметный дискомфорт в течение большей части цикла; 1 – слабые, временами ощущение дискомфорта или боли перед менструацией);
альгодисменорея (3 балла – сильная, заставляет больную оставаться в постели целый день или несколько дней; 2 балла – умеренная заставляет больную оставаться в постели несколько часов в день, временами – нетрудоспособность; 1 балл – слабая, с некоторым нарушением трудоспособности);
диспареуния – боль во время полового сношения (3 балла – настолько сильная, что вынуждает избегать сношений; 2 балла – умеренная, что вынуждает прервать сношение; 1 балл – имеется, но терпимая);
дисменорея (3 балла - кровомазание до менструации от 4-х до 7 дней; 2 балла – от 1 до 3 дней; 1 балл – периодически появляющиеся кровомазания до менструации);
выраженность менструаций (3 балла – обильные, 2 балла – умеренные менструации, 1 балл – скудные менструации).
Проводили бимануальное исследование и УЗИ гениталий. Определение в сыворотке крови уровней опухолевых маркеров (CEA, СА-125, СA19-9, СА-15-3), антигенов вируса гепатита В, титров антител к антигенам Сhlamydia trachomatis, Toxoplasma gondii, Mycobacterium tuberculosis и вируса гепатита С проводили методом иммуноферментного анализа.
До лечения болевой синдром в 9 баллов наблюдался у всех 22 человек, страдающих генитальным эндометриозом и сочетанными формами эндометриоза и миомы матки. Дисменорея оценивалась 3 баллами у всех больных генитальным эндометриозом и сочетанными формами эндометриоза и миомы матки.
При бимануальном исследовании и УЗИ гениталий у всех пациенток в той или иной степени определялась неоднородность консистенции миометрия, перемежающиеся участки уплотнений и тестоватости в толще матки, увеличение размеров матки. В области перешейка отмечалась умеренно выраженная пастозность, резкая болезненность. При УЗИ гениталий у всех наблюдаемых 12 больных генитальным эндометриозом выявлены признаки аденомиоза матки 3 и 4 степени. У пациенток с сочетанными формами эндометриоза и миомы матки определялись на фоне неоднородной мозаичной структуры интерстициальные, субсерозные и субмукозные (у 5 больных) узлы диаметром от 22 до 33 мм, дающие акустическую дорожку. Размеры матки во всех наблюдениях были увеличены до 9-16 недель.
Показатели опухолевых маркеров были повышены до лечения у всех пациенток, но не превышали границ доброкачественности. Средние значения СА-125 в целом в группе составили: 44,7±1,34 Ед/мл, СА-19-9 28,9±1,5 Ед/мл, СA-15-3 53,2±4,3 Ед/мл, CEA 1,29±0,38 нг/мл.
Через 1 месяц после проведенной вакцинации были повторно обследованы все больные. При бимануальном исследовании у пациенток, страдающих эндометриозом, значительно уменьшились размеры матки, консистенция миометрия чаще была однородной или с небольшими участками уплотнений. При наличии миомы матки с узлами различных размеров наблюдалось уменьшение узлов и тела матки. При генитальном эндометриозе все благоприятные сдвиги были выражены ещё значительнее. У всех наблюдаемых больных эндометриозом УЗИ гениталий выявило уменьшение размеров матки и очагов генитального эндометриоза, у пациенток с сочетанными формами эндометриоза и миомы матки определялось уменьшение размеров интерстициальных, субсерозных и субмукозных узлов диаметром от 16 до 26 мм. Размеры матки во всех наблюдениях уменьшились до 5-11 недель (Рис. 2).

Рис. 2. Размер матки
У 7-ми пациенток наблюдалась нормализация размеров матки, у этих же пациенток при УЗИ подтверждено полное исчезновение миоматозных узлов. У 2-х пациенток, имевших кистозные образования яичников, мы наблюдали их полное исчезновение (размеры рассосавшихся кист составили от 14,5 см3 до 26,4 см3 ).

Рис. 3. Выраженность болевого синдрома
Болевой синдром у 22 человек, страдающих генитальным эндометриозом и сочетанными формами эндометриоза и миомы матки, снизился до 5-7 баллов (Рис. 3).

Рис. 4. Дисменорея
осле вакцинации дисменорея оценивалась 1 баллом у всех больных эндометриозом и сочетанными формами эндометриоза и миомы матки (Рис. 4).
Ни в одном из случаев мы не наблюдали клинического ухудшения. Больные отмечали уменьшение отеков, исчезновение болевых ощущений в области эстрогензависимых органов, общее улучшение самочувствия, повышение настроения.
 Рис. 5. Изменение уровней опухолевых маркеров.
Рис. 5. Изменение уровней опухолевых маркеров.
Изменение уровней опухолевых маркеров было различным в зависимости от вида маркера (Рис. 5). Так, уровни СA-19-9 после вакцинации повышались в среднем на 23% (P < 0,1%) от первоначального уровня в течение месяца, через 2 месяца они были меньше первоначального на 15%. Уровни СA-125 в среднем равномерно снижались до 25% (P < 0,1%) от исходного. Уровни СA-15-3 снижались на 38% (P < 0,1%) от первоначального уровня уже в течение первого месяца после вакцинации. Средние значения СA-15-3 через 2 месяца после вакцинации составили 31,0 Ед/мл (P < 0,1%). Изменения этих показателей указывают на положительную динамику и эффективность данной иммунотерапии.
При сопоставлении полученных результатов выявлено, что применение вакцины РЕСАН вызывает значительное улучшение состояния больных и показателей объективного исследования у всех наблюдаемых пациенток.
Мы рекомендуем обследование больных перед вакцинацией на наличие хламидийной, туберкулезной инфекции, а также на носительство вирусных гепатитов В и С. В случае обнаружения высоких титров антител к указанным инфекциям необходимо провести предварительную санацию организма (антибиотиками, интерферонами, интерлейкинами) с последующей вакцинацией РЕСАН.
Иммунотерапия ксеногенной вакциной РЕСАН эндометриоза и его сочетанных форм с миомой матки приводит к регрессии или полному исчезновению очагов эндометриоза, миоматозных узлов и кистозных образований яичников.
2. Публикация работы в РФ: РЕСАН в лечении эндометриоза
3. Медицинский университет имени. K. Marcinkowskiego (Польша). Исследования РЕСАН при эндометриозе
4. РЕСАН в Przegląd Menopauzalny 2007; 5: 283–288
5. Работы Szymanowski K. – эксперта в области эндометриоза
Информационные источники
1.Gleicher, N. (1995). Immune dysfunction - a potential target for treatment in endometriosis. British Journal of Obstetrics and Gynaecology. 102 (Suppl.12), 4-7.
2.The Oxford Clinic- The Endometriosis Treatment Centre.
3.IVF.com, Atlanta, USA.-Endometriosis Association, Education Support Research.
4.Article: Uterine fibroids. Review Date: 04/09/01 Reviewed By: Catherine S. Bradley, M.D., Department of Obstetrics and Gynecology, University of Pennsylvania Medical Center, Philadelphia, PA.
5.Ballweg, ML. (1995). The Endometriosis Sourcebook. The Endometriosis Association. Contemporary Books.
6.Duczman, L. & Ballweg, ML. (1999). Endometriosis and Cancer: What is the connection? Endometriosis Association International Headquarters.
7.Senturk, LM. & Arici, A. (1999). Immunology of endometriosis. Journal of Reproductive Immunology. 43(1) 67-83.
8.Vinatier, D., Cosson, M. & Dufour, P. (2000). Is endometriosis an endometrial disease? European Journal of Obstetrics, Gynaecology and Reproductive Biology. 91(2) 113-25.
10."Deep endometriosis conundrum: evidence in favor of a peritoneal origin," Fertil Steril 2000 May;73(5):1043-6 (ISSN: 0015-0282) by Vercellini P; Aimi G; Panazza S; Vicentini S; Pisacreta A; Crosignani PG.
11."Liver Health & Endometriosis," Julia Chang, M. Sc.
12.The Center for Endometriosis Care, Atlanta, GA.
14."Endometriosis 2000: a Report," by Dr. Mark Perloe.
15."Non-Invasive Diagnostic Detection of Endometriosis," NIH Grant # 1 RO1 CA96575-01, submitted by Rosalyn Blumenthal, Ph.D., Member/Director Tumor Biology, Garden State Cancer Center.
16.Professor Stephen Smith, Head of investigation of cellular, molecular and genetic factors which regulate angiogenesis and embryo implantation, University of Cambridge/Department of Pathology. On-line.
17.Deborah Metzger, Ph.D., Director, and Andrew Cook, M.D., Co-Director, Helena Women's Health Center. On-line.
18."Immunopathology of Endometriosis," by The Reproductive Research Center at the Cleveland Clinic Foundation, Cleveland, OH. On-line.
19.Gleicher N. Immune dysfunction--a potential target for treatment in endometriosis. Br J Obstet Gynaecol 1995 Oct;102 Suppl 12:4-7.
20.Gleicher N, Pratt D. Abnormal (auto)immunity and endometriosis.
Int J Gynaecol Obstet 1993;40 Suppl:S21-7.
21.Gleicher N. Endometriosis: a new approach is needed. Center for Human Reproduction, Chicago, IL. Hum Reprod 1992 Jul;7(6):821-4
22.The vaccinotherapy of patients with mastopathy, endometrios and mioma of uterus A. Ovsienko, H. Doronina , V. Yanchenko Journal of Immunopathology: http://iaci.ru/journal/ http://iaci.ru/journal/issue2/full_text/sec6ar2.pdf
23.Novikov D.K., Novikiva V. I., Derkatch U.N., Novikov P.D. The basic immune corrections. Vitebsk, 1998, pg. 106.
24.Yantchenko V.V., Yantchenko A.V., Yantchenko L. K. Immitators of the tumor antigens. The patent committee RB, appl. N970547, 1997.
25.Immunology, Infertility and IVF, Sher Institute for Reproductive Medicine. On-line.
26.Endometriosis Protocol. On-line.
27.Эндометриоз: клиника, диагностика и лечение. Р.А. Саидова. Кафедра акушерства и гинекологии ММА им. И.М. Сеченова. On-line.
28.Gaetje R. Kuteian S., Herrmann G. Invasiveness of endometriotic cells in vivo. // Lancet, 1995, V346, P 463-1464.
29.Gamallo C., Palacios J., Suarez A. Correlation of E-cadherin expression with differentiation grade and histological type in breast carcinoma. // Am. J. Pathol., 1993, V 42, P987-993.
30.Inoue M., Ogawa F., Miyata M. Expression of E-cadherin in normal, benign, and malignant tissues of female genital organs. // Am. J. Clin. Pathol., 1992, V98, P76-80.
31.Jimbo H., Hitomi Y., Yoshikawa F. Evidence for monoclonal expansion of epithelial cells in ovarian endometrial cyst. // Am. J. Pathol., 1997, V 50, P 73-1178.
32.Союнов М. А. Клиника, диагностика и лечение узловатой формы аденомиоза. // Акушерство и гинекология. – 1987. - № 3. – С. 34-36.
33.Лопухов Д. А. Клинико-диагностическая характеристика сочетанной доброкачественной патологии матки в перименопаузе: Автореферат дис. канд. Мед. Наук: 14.00.01. – М., 1992. – 33 с.
34.Новые данные о патогенезе внутреннего эндометриоза. / М. М. Дамиров, В. И Кулаков, Л. П. Бакулева и др. // Акушерство и гинекология. – 1993. № 5. – С. 28-32.
35.Ferenczy A. Pathophysiology of adenomyosis. // Hum. Reprod. Update. - 1998. - Vol. 4, № 4. – P. 312-322.