Взаимодействие системы иммунитета и опухоли

Канцерогены
В течение жизни на многих людей действуют канцерогены (химические, физические, вирусные), которые приводят к стойким изменениям нуклеотидной последовательности ДНК нормальных клеток.
В результате этих изменений возникает раковая клетка, которая приобретает новые свойства:
1) способность к бесконечному количеству митозов;
2) способность к метастазированию;
3) способность активно противостоять системе иммунитета.
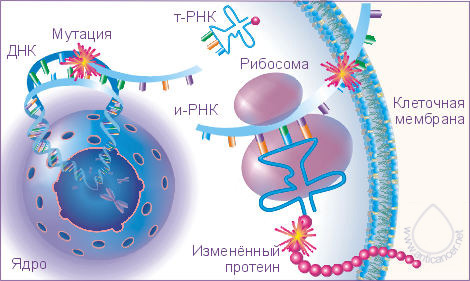 Рис. 1. Мутаци
Рис. 1. Мутаци
При опухолевой трансформации может нарушаться работа отдельных генов.
Возможность возникновения опухоли зависит от 4-х условий:
1) дозы канцерогена;
2) времени воздействия канцерогена;
3) генетической предрасположенности;
4) присутствия ускорителей (эстрогены, желчные кислоты, поваренная соль, фенобарбитал и др.) и замедлителей опухолевого роста (витамины А, Е, С, аспирин и др.).
Основным элементом распознавания «своего» и «чужого» служат молекулы главного комплекса гистосовместимости (сокращённо MHC - от англ. major histocompatibility complex), у человека он обозначается HLA (human lymphocyte antigens) и кодируется в 6-ой хромосоме. Система HLA обладает широким полиморфизмом, представлена комплексом генов HLA – A, B, C, E, F, G, DR, DQ, DP, TAP1, TAP2, LMP-2, LMP-7 и другими. Часть собственных белков, синтезированных клеткой, сразу расщепляется мультикаталитическим протеасомным комплексом, субъединицами которого являются продукты генов LMP-2 и LMP-7. Функцией LMP-2 и LMP-7 является приведение размеров пептидов в соответствие со связывающими сайтами молекул HLA (Рис. 2 и Рис. 3).
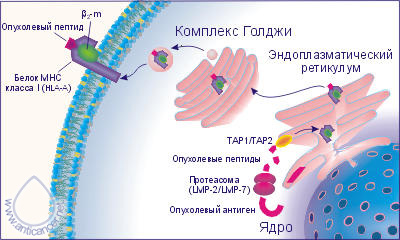
Рис. 2. Представление пептидных фрагментов антигенов
опухолевой клетки в комплексе с молекулами HLA I класса

Рис. 3. Наномерный пептидный фрагмент опухолевого антигена
в комплексе с молекулой HLA I класса, А (вид сбоку), Б (вид сверху)
Каждый человек имеет 2 набора HLA генов, один получен от отца, второй от матери. Существует большое разнообразие вариантов генов HLA – A, B, C, E, F, G, DR, DQ, DP. Эти варианты называются аллелями и обозначаются цифрами.
Например, по основным молекулам HLA класса I фенотип человека может выглядеть следующим образом: HLA-A3, 34; B14, 58; Cw6,3. От этого зависит, какие пептидные фрагменты опухолевого антигена будут представлены на поверхности опухолевой клетки в комплексе с молекулами HLA класса I, а какие – нет.
Так, у человека с HLA-A3 фенотипом фрагменты Human cancer associated surface antigen (использовано однобуквенное международное обозначение аминокислот):
maitqfrlfkfctclatvfsflkrlicrsgrgrklsgdqitlpttvdyssvpkq tdveewtswdeaptsvkiegdgngnvatqqnsleqlepdyfkdmtptirktqki vikkreplnfgipdgstgfssrlaatqdlpfihqsselgdldtwqentnaweee edaawqaeevlrqqkladrekraaeqqrkkmekeaqrlmkkeqnkigvkls
на поверхности опухолевой клетки будут представлены иначе, чем у человека с HLA-A1 фенотипом, как количественно, так и качественно. У человека с HLA-A3 фенотипом будет с наибольшей вероятностью представлено 35 наномерных фрагментов, а для человека с HLA-A1 фенотипом – только 11 наномерных фрагментов (Табл. 1, жирным шрифтом выделены якорные аминокислоты).
| HLA-A3 | HLA-A1 |
| Начало позиции, наномерный пептидный фрагмент |
Начало позиции, наномерный пептидный фрагмент |
| 2 AITQFRLFK 7 RLFKFCTCL 14 CLATVFSFL 24 RLICRSGRG 25 LICRSGRGR 26 ICRSGRGRK 34 KLSGDQITL 39 QITLPTTVD 40 ITLPTTVDY 45 TVDYSSVPK 50 SVPKQTDVE 56 DVEEWTSWD 64 DEDAPTSVK 70 SVKIEGGNG 72 KIEGGNGNV 86 SLEQLEPDY 89 QLEPDYFKD 99 TPTIRKTQK 103 RKTQKIVIK 108 IVIKKREPL 118 FGIPDGSTG 119 GIPDGSTGF 130 RLAATQDLP 169 AEEVLRQQK 171 EVLRQQKLA 172 VLRQQKLAD 177 KLADREKRA 183 KRAAEQQRK 184 RAAEQQRKK 187 EQQRKKMEK 191 KKMEKEAQR 194 EKEAQRLMK 195 KEAQRLMKK 199 RLMKKEQNK 203 KEQNKIGVK |
16 ATVFSFLKR 36 SGDQITLPT 40 ITLPTTVDY 54 QTDVEEWTS 86 SLEQLEPDY 89 QLEPDYFKD 112 KREPLNFGI 134 TQDLPFIHQ 143 SSELGDLDT 185 AAEQQRKKM 194 EKEAQRLMK |
На поверхности всех клеток находятся антигены, выполняющие разнообразные функции, необходимые для обеспечения жизнедеятельности. Некоторые антигены имеют несколько названий.
Против каждого опухолевого антигена получено большое количество моноклональных антител (МКА). The International Society for Oncodevelopment Biology and Medicine – ISOBM (Международное Общество по Развитию Онкобиологии и Медицины) регулярно проводит совещания по тканевой дифференцировке (Tissue Differentiation (TD) Workshops) с целью характеристики МКА, направленных против молекул, которые могут быть потенциальными опухолевыми маркерами.
Несколько антигенов, связанных с человеческими опухолями, присутствуют в фетальных тканях, но отсутствуют в соответствующих тканях взрослого. Это онкофетальные антигены. Им принадлежит чрезвычайно важная роль в опухолевом росте. В фетальных тканях эти антигены присутствуют в виде полипептидов, чей синтез управляется генами, и обеспечивают клеткам эффективный метаболизм. После рождения участки генов, кодирующие эти полипептиды, утрачивают свою активность, и синтез фетальных антигенов прекращается.
В опухолевых клетках повторно активизируются гены, активные в фетальных тканях. Однако, в отличие от фетальных тканей, онкофетальные антигены являются гликопротеинами. Это происходит в результате посттрансляционного гликозилирования фетальных белков.
Онкофетальные антигены присутствуют в спонтанных, индуцированных химическими канцерогенами и вирусиндуцированных опухолях. Они обеспечивают опухолевым клеткам повышенный метаболизм. Так, AFP (ТD-2) - a-фетопротеин, антиген с молекулярной массой 70 кДа – является сывороточным маркером гепатоцеллюлярной карциномы. Рецептор к AFP обнаружен при ряде опухолей человека.
СЕА (TD-8), карциноэмбриональный антиген, является гликопротеином с молекулярной массой 200 кДа, экспрессированным на клеточной поверхности. Повышенный уровень СЕА обнаруживается в сыворотке 30% больных раком легких, печени, поджелудочной железы, молочной железы, толстой кишки, головы и шеи, мочевого пузыря, шейки матки и простаты. У больных с метастатическими опухолями повышенный сывороточный уровень антигена наблюдается в 60% случаях.
Онкофетальные антигены входят в группу так называемых опухольассоциированных антигенов, причём одни и те же опухольассоциированные антигены встречаются при различных заболеваниях. Все опухольассоциированные антигены были обнаружены в эмбриональных и нормальных тканях, но содержание этих антигенов в нормальных тканях незначительно.
Есть антигены, которые присутствуют только на опухолевых клетках. Они составляют группу опухольспецифичных антигенов. Среди опухольассоциированных или опухольспецифичных антигенов, применяемых для создания противораковых вакцин, можно выделить антигены, экспрессирующиеся в опухолевых, но не в нормальных клетках. К ним относятся антигены, кодируемые генами BAGE, GAGE, MAGE. Например, семейство MAGE включает 15 генов, расположенных в Х-хромосоме.
MAGE-1 антиген выявляют в 36% случаев меланом, в существенном количестве препаратов рака молочной железы, крупноклеточных карцином легкого и карциномах головы и шеи.
MAGE-3 антиген обнаружен у 65% меланом и 48% карцином головы и шеи. Два других семейства генов – GAGE и BAGE – кодируют синтез подобных опухольспецифичных антигенов.
СА 125 (TD-1) антиген является специфическим маркером рака яичника, этот гликопротеид с молекулярной массой 200 кДа экспрессирован на поверхности опухолевых клеток. При I стадии рака яичника повышенный уровень СА 125 обнаруживают в 50% случаев, при II стадии – в 90% случаев, при III стадии – в 92% случаев, при IV стадии – в 94% случаев. Хотя СА 125 антиген считается специфическим маркером рака яичника, повышенные уровни этого антигена выявляются и при многих других заболеваниях, например, в 15% случаев рака молочной железы, в 30% случаев рака легких, в 31% случаев рака желудка, в 67% случаев цирроза и в 100% случаев цирроза с асцитом.
PSA (ТD-3) – простатический специфический антиген с молекулярной массой 33 кДа – является специфическим маркером рака предстательной железы. Антиген экспрессирован и в ткани нормальной предстательной железы, а при раке сывороточный уровень PSA повышается. Определение уровня PSA в сыворотке крови используют для дифференциальной диагностики и мониторинга эффективности лечения рака простаты.
MUC-1 (ТD-4) – муциноидный раковый антиген - является раково-ассоциированным муцином. Муцин содержится в цитоплазме нормальных железистых клеток молочной железы и яичников. Однако, MUC-1 антиген сильно экспрессирован на поверхностной мембране опухолевых клеток при раке молочной железы, яичников, щитовидной железы, легких. MUC-1 имеет молекулярную массу 300 - 450 кДа. Повышение содержания MUC-1 может развиваться и при некоторых доброкачественных процессах: доброкачественных опухолях молочной железы и яичников, эндометриозе, гепатите, циррозе печени, фиброзе легких. Беременность и лактация также могут приводить к повышению уровня MUC-1. Тест-системы для определения этого антигена имеют различные названия: BCM, CA15-3, CA153, CA27.29, CF15-3, MCA, M12, M20, M22 и другие.
Цитокератины (TD-5). В опухолевых клетках имеет место аберрантная экспрессия кератинов, которые выявляются МКА. Против эпитопов цитокератинов получено более 30 различных МКА.
СА-19-9 (ТD-6) – сиалированный Lewis A антиген (Sialyl Lewis A) - является опухольассоциированным углеводным антигеном. Сывороточный уровень CA19-9 повышается у некоторых больных раком легких, раком поджелудочной железы. Сиалированный Lewis A антиген обнаружили иммуногистологически с помощью МКА NS19-9 в 75,4% случаев первичной гепатоцеллюлярной карциномы и в 78,5% случаев метастазов в регионарные лимфатические узлы.
СА 195 похож на антиген СА 19-9. Его уровень повышен в сыворотках 50-70% больных опухолями желудочно-кишечного тракта.
DUPAN-2, предшественник CA19-9, является sialyllact-N-tetraose (LSTa, sialyl-Lewis(c)). Иммуногистологически антиген DUPAN-2 обнаружен во всех типах злокачественных эпителиальных опухолей легких, включая плоскоклеточную карциному, где он был локализован на клеточной поверхности. При аденокарциномах, крупноклеточных карциномах и мелкоклеточных карциномах антиген локализован как на клеточной поверхности, так и в цитоплазме. DUPAN-2 обнаруживают в Lewis-негативных сыворотках больных раком поджелудочной железы. Измененная экспрессия антигена группы крови Lewis Y (LeY), появляющаяся при злокачественной трансформации, также является опухолевым маркером. Антиген LeY экспрессирован на клеточной мембране и в цитоплазме опухолевых клеток при гепатоцеллюлярной карциноме.
Ещё одним антигеном, встречающимся на мембранах клеток многих опухолей, является человеческий хорионический гонадотропин (human chorionic gonadotrophin, hCG) (TD-7).
Антигеном, выявляемым в опухолях костей, является костная щелочная фосфатаза (TD-9).
Определение перечисленных выше и многих других опухольассоциированных антигенов широко используется для иммунодиагностики опухолей и создания новых противораковых вакцин.

Рис. 4. Мембрана нормальной клетки

Рис. 5. Мембрана злокачественной клетки
Токсинвыводящие гликопротеины и множественная лекарственная устойчивость опухоли к химиопрепаратам
Жизнеспособность любого организма зависит от способности клеток выводить токсины, попадающие в них извне, а также образуемые в процессе функционирования. Для этой цели в плазматической мембране клетки предназначена целая группа АТФ-связанных кассетных транспортных белков (ATP-binding cassette transporter proteins). Чем больше токсинов поступает в клетку или образуется в ней, тем активней идёт транскрипция и трансляция генов, кодирующих эти белки. Лекарственные препараты могут менять активность этих генов. Так, химиотерапевтические противоопухолевые препараты: винкристин, доксорубицин, цисплатин, циклофосфамид и другие в 10 и более раз усиливают синтез опухолевыми клеткам токсинвыводящих белков, в то время как блокаторы кальциевых каналов – верапамил, фенигидин, блокатор натриевых каналов – хинидин, антибиотики – цефалоспорин, грамицидин, пуромицин, циклоспорин А, препараты раувольфии – резерпин в 2-5 раз подавляют активность генов, ответственных за синтез токсинвыводящих белков.
В хромосомном локусе 7q21.1 человека расположены 3 гена MDR1, MDR2 и MDR3 кодирующие токсинвыводящие гликопротеины. В иммунологии очень часто один и тот же белок имеет несколько названий. Так продукт гена MDR1 - гликопротеин P имеет следующие названия и символы (ATP-BINDING CASSETTE, SUBFAMILY B, MEMBER 1; ABCB1; P-GLYCOPROTEIN 1; PGY1; MULTIDRUG RESISTANCE 1; MDR1; GP170; DOXORUBICIN RESISTANCE). Гликопротеин P (от англ. permeability - проницаемость) находится в плазматической мембране и служит для удаления из клеток метаболических токсинов. Его молекулярная масса 170000 Да. Благодаря значительному количеству этого гликопротеина у опухолевых клеток развивается феномен множественной лекарственной устойчивости. Опухолевые клетки быстро и эффективно выводят применяемые для их уничтожения химиотерапевтические средства. С повышенной активностью MDR1 гена связана с устойчивость опухолевых клеток к доксорубицину (адриамицину).
Продукт гена MDR3 – P-гликопротеин 3 имеет следующие названия и символы (ATP-BINDING CASSETTE, SUBFAMILY B, MEMBER 4; ABCB4; P-GLYCOPROTEIN 3; PGY3; MULTIDRUG RESISTANCE 3; MDR3).
В том же хромосомном локусе 7q21.1 расположен ген, кодирующий белок сорсин (SORCIN; SRI; MULTIDRUG-RESISTANCE COMPLEX, CLASS 4; MDR COMPLEX, CLASS 4), подобный гликопротеинам P. Сорсин является кальций связывающим протеином, обеспечивающим работу кальциевых каналов. Повышенная активность этого белка обеспечивает устойчивость опухолевых клеток к винкристину.
В хромосомном локусе 3q27 расположен ген, кодирующий пятый протеин множественной лекарственной устойчивости (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 5; ABCC5; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 5; MRP5; MOATC). С ним связана устойчивость к химиотерапевтическим препаратам, содержащим платину.
В хромосомном локусе 16p13.1 расположен ген, кодирующий первый протеин, ассоциированный с множественной лекарственной устойчивостью. (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 1; ABCC1; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 1; MRP1; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN; MRP). Он осуществляет транспорт лейкотриенов и обеспечивает защиту от оксианионов тяжёлых металлов. Функция этого белка блокируется ингибиторами 5-липоксигеназы.
В хромосомном локусе 10q24 расположен ген, кодирующий второй протеин, ассоциированный с множественной лекарственной устойчивостью. (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 2; ABCC2; MULTISPECIFIC ORGANIC ANION TRANSPORTER, CANALICULAR; CMOAT; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 2; MRP2). Он осуществляет транспорт органических анионов и обеспечивает устойчивость к нуклеозид-содержацим противоопухолевым химиопрепаратам.
В хромосомном локусе 17q22 расположен ген, кодирующий третий протеин, ассоциированный с множественной лекарственной устойчивостью. (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 3; ABCC3; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 3; MRP3; CANALICULAR MULTISPECIFIC ORGANIC ANION TRANSPORTER 2; CMOAT2). Он также осуществляет транспорт органических анионов и обеспечивает устойчивость к нуклеозид-содержацим противоопухолевым химиопрепаратам.
В хромосомном локусе 13q32 расположен ген, кодирующий четвёртый протеин, ассоциированный с множественной лекарственной устойчивостью. (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 4; ABCC4; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 4; MRP4; MULTISPECIFIC ORGANIC ANION TRANSPORTER B; MOATB). Он тоже осуществляет транспорт органических анионов и также обеспечивает устойчивость к нуклеозид-содержащим противоопухолевым химиопрепаратам.
В хромосомном локусе 3q27 расположен ген, кодирующий пятый протеин, ассоциированный с множественной лекарственной устойчивостью. (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 5; ABCC5; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 5; MRP5; MULTISPECIFIC ORGANIC ANION TRANSPORTER C; MOATC). Он тоже осуществляет транспорт органических анионов, а также обеспечивает устойчивость к химиотерапевтическим препаратам, содержащим платину.
В хромосомном локусе 16q12.1 расположены ещё 2 гена, кодирующие восьмой и девятый протеины, ассоциированныее с множественной лекарственной устойчивостью. (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 11; ABCC11; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 8; MRP8), (ATP-BINDING CASSETTE, SUBFAMILY C, MEMBER 12; ABCC12; MULTIDRUG RESISTANCE-ASSOCIATED PROTEIN 9; MRP9).
В хромосомном локусе 16p13.1-p11.2 расположен ген, кодирующий лёгочный протеин, связанный с устойчивостью (MAJOR VAULT PROTEIN, RAT, HOMOLOG OF; MVP; LUNG RESISTANCE-RELATED PROTEIN; LRP). Его молекулярная масса 110000 Да. С ним также связана множественная лекарственная устойчивость к противоопухолевым химиопрепаратам.
Учитывая такое количество генов и соответственно белков, ответственных за множественную лекарственную устойчивость опухолевых клеток к химиотерапевтическим препаратам становится понятным, почему почти вековое использование и совершенствование химиотерапевтических препаратов не принесло желаемого результата от такого метода лечения рака. Чтобы подвергать организм воздействию небезопасных химиотерапевтических препаратов необходимо проводить генодиагностику и лишь после этого решать вопрос о целесообразности применения того или иного химиотерапевтического препарата. После первого успешного применения химиотерапевтического препарата необходимо обязательно проводить его замену, на другой, по той причине, что первый препарат обычно в 10 и более раз усиливает синтез опухолевыми клеткам токсинвыводящих белков, удаляющих из клетки этот препарат. Новый химиопрепарат, также необходимо назначать после повторной генодиагностики, если в организме остались опухолевые клетки, и выбирать только тот препарат, который слабо выводится опухолевыми клетками. В противном случае химиотерапевтический препарат подавляет работу системы иммунитета, оказывает токсической действие на различные органы и системы, практически не влияя на рост опухоли, что ускоряет гибель больного.
Главным элементом активной противоопухолевой защиты в организме являются цитотоксические Т-лимфоциты, или Т-киллеры (от англ. killer - убийца). На поверхности опухолевой клетки антигены представлены не только в виде единой молекулы, как показано на Рис. 5, но и в виде фрагментов в комплексе с молекулами HLA (Табл. 1, Рис. 2 и Рис. 3).
Распознавание опухоли Т-киллерами зависит от наличия на опухолевой клетке различных антигенов, причем для Т-лимфоцитов важна последовательность аминокислот полипептидной цепи, а не то, каким образом она уложена в пространстве. Чтобы Т-лимфоцит ответил на антиген, он должен быть представлен антигенпредставляющей клеткой (APC, от англ. antigen presenting cell). К APC относятся В-лимфоциты, макрофаги, дендритные клетки, которые специализируются на переработке чужеродного и собственного дефектного материала. Антигенный белок поглощается APC. Внутри клетки белок расщепляется на пептидные фрагменты длиной до 10-20 аминокислот. Эти пептидные фрагменты перемещаются на плазматическую мембрану APC и вместе с молекулами HLA образуют рецепторы, распознаваемые Т-лимфоцитами. Для этого у Т-лимфоцитов имеется собственный Т-клеточный рецептор (TCR, от англ. T-cell receptor). TCR состоит из комплекса пептидов – a, b, e, g, d, z, h, каждый из которых кодируется отдельным геном. Связывания TCR с опухолевым пептидом, представленным молекулой HLA, обычно недостаточно для действия Т-киллера. Необходимо связывание ещё одной молекулы Т-киллера – CD8-корецептора – с молекулой HLA клетки-мишени. TCR у Т-киллеров и Т-хелперов (от англ. help - помощь) кодируются одинаковыми генами, но корецептор у хелперов представлен другим белком – CD4. Корецептор-CD4 связывается с HLA класса II, корецептор CD8 – с молекулами HLA класса I. Если незрелой Т-клетке антиген представляет макрофаг с белком HLA класса I, то возникает клон Т-киллеров. Если антиген представляет макрофаг с белком HLA класса II, то возникает клон Т-хелперов. В популяции человека существует много белков HLA, но у каждого индивида имеется лишь по два гена для молекул HLA каждого типа.
Способность Т-киллеров отвечать на опухолевые клетки также зависит от молекул MHC опухолевой клетки. Молекулы MHC класса I кодируются в опухолевых клетках мыши генами H-2K и H-2D, а у человека – генами HLA-A, HLA-B, HLA-C. Ген HLA-A человека соответствует гену H-2K мыши. CD8-корецептор Т-киллера эффективно связывается с молекулой H-2K и не связывается с молекулой H-2D. Чем больше молекулы H-2K преобладают на плазматической мембране над молекулами H-2D, тем более заметными для Т-киллеров становятся опухолевые клетки. Чем выше экспрессия гена H-2D, тем чаще опухолевые клетки ускользают от иммунного ответа Т-киллеров в кровеносном русле и дают метастазы.
Экспрессия генов H-2K и H-2D изменчива. Интерфероны a и b, введённые вместе, индуцируют экспрессию гена H-2D, а g-интерферон усиливает экспрессию гена H-2K. Таким образом, экспрессию генов H-2K и H-2D можно регулировать, усиливая тем самым ответ Т-киллеров на опухоль. Кроме этого, γ-интерферон подавляет ангиогенез.
Т-киллер, связавшись своими рецепторами с опухолевой клеткой, вступает с ней в плотный контакт, для чего необходим Mg++, и выбрасывает белки перфорины. Перфорины встраиваются в мембрану опухолевой клетки и в присутствии Ca++ полимеризуются, образуя каналы, через которые в клетку входит избыточное количество воды, и опухолевая клетка разрывается. Т-киллер уничтожает лишь несколько опухолевых клеток, после чего в нём истощаются запасы энергии и перфоринов, и он погибает сам.
NK-клетки
Важным элементом противоопухолевой защиты являются естественные клетки-убийцы, сокращённо – NK-клетки (от англ. nature kller). У здорового человека в норме количество NK-клеток должно быть не менее 170 в одном микролитре. Эти клетки принимают активное участие в противовирусной и противоопухолевой защите. Особенностью действия NK-клеток является то, что они уничтожают клетки, на которых снижена экспрессия молекул HLA I класса.
На поверхности натурального киллера имеются несколько важных молекул, от которых зависит, быть или не быть цитотоксическому ответу. Одной из таких молекул является CD16 (низкоаффинный рецептор к иммуноглобулину G (IgG)). Если на поверхности опухолевой клетки имеются антитела G класса, то именно через эти антитела натуральный киллер, с участием CD16 молекулы, присоединяется к опухолевой клетке. Другой важной группой молекул, присутствующей на поверхности натуральных киллеров, являются CD158 молекулы, которые имеют ещё два названия: иммуноглобулинподобный рецептор киллерных клеток (KIR) или ингибирующий рецептор киллерной клетки (KIR). KIR семейство включает в себя 12 генов. Различные KIR молекулы взаимодействуют с различными HLA-молекулами I класса. KIR-молекулы NK-клеток исполняют роль рецепторов для молекул HLA I класса нормальных клеток нашего организма (Табл. 2).
Табл. 2. Лиганд-рецепторное взаимодействие NK-клеток
Ингибиторную функцию у NK-клеток также осуществляет молекула CD94/NKG2, которая специфична для HLA-E молекул. В отличие от KIR молекула CD94/NKG2 относится к лектинподобным молекулам. В норме на всех ядросодержащих клетках нашего организма присутствуют молекулы HLA I класса. При заражении клеток организма вирусами или при опухолевой трансформации клеток может изменяться экспрессия этих HLA молекул. Уменьшение экспрессии молекул HLA I класса отменяет ингибирующее действие KIR молекул NK-клеток и неполноценная клетка уничтожается натуральными киллерами.
Таким образом, натуральные киллеры защищают наш организм от опухолевых клеток с низкой экспрессией HLA молекул. После плотного контакта натурального киллера с опухолевой клеткой осуществляется выброс NK-клеткой белков - перфоринов, которые встраиваются в мембрану опухолевой клетки и образуют пору. После этого натуральный киллер отходит от опухолевой клетки, а через образованные перфоринами поры в опухолевую клетку начинает поступать межклеточная жидкость, опухолевая клетка набухает и разрушается. На поверхности NK-клеток имеется большое количество активационных молекул. Это рецепторы к IFN-g, IL-2, IL-12, IL-15, IL-18. На поверхности всех натуральных киллеров имеется молекула, называемая FAS-лиганд (CD178), вызывающая программируемую гибель клетки-мишени. Активация NK-клеток интерлейкином-2, интерлейкином-12 приводит к усилению экспрессии (CD 178) на NK-клетках. Взаимодействие CD16 с IgG оказывает аналогичное действие. Таким образом, уничтожение опухолевой клетки может происходить и через взаимодействие CD178 с рецепторами апоптоза на опухолевых клетках. У людей, имеющих малое количество и/или низкую функциональную активность NK-клеток, значительно чаще развиваются онкологические заболевания.
LAK-клетки
Уничтожать опухолевые клетки могут и активированные лимфоциты, называемые LAK-клетками (от англ. lymphokine activated killer - лимфокином активированные киллеры), которые происходят из "нулевой" популяции лимфоцитов. Как и NK-клетки, они уничтожают опухолевые клетки без предварительного распознавания определённого антигена. Противоопухолевая активность LAK-клеток усиливается, если вводить их вместе с интерлейкином-2. Однако большие дозы интерлейкина-2 вызывают токсическое действие, проявляющееся в выраженном отёке органов и тканей.
Макрофаги
Опухолевые клетки синтезируют фактор, ингибирующий миграцию макрофагов (МИФ), который является необходимым элементом опухолевого роста. МИФ в опухолевом росте выполняет одновременно две важные функции. Под действием МИФ макрофаги, пришедшие к опухоли, теряют свою подвижность, но сохраняют способность синтезировать биологически активные вещества. МИФ лишает макрофаги возможности передать информацию об обнаруженной опухоли другим иммунокомпетентным клеткам, позволяет опухоли использовать обездвиженный макрофаг как фабрику по производству большого количества активатора плазминогена. Благодаря активатору плазминогена, синтезируемому макрофагами, опухолевые клетки приобретают способность проникать в кровеносное русло и распространяться по организму.
При активации Т-лимфоцитами макрофаги превращают аргинин в окись азота и с помощью этого токсичного свободнорадикального соединения убивают опухолевые клетки. Это происходит следующим образом. Активированный Т-лимфоцит выделяет γ-интерферон. Он подаёт сигнал, мишенью которого является ядро макрофага. Этот сигнал вызывает образование синтазы окиси азота, превращающей аргинин в окись азота, которая разрушает опухолевые клетки, подавляя энергообразование в цикле Кребса и при транспорте электронов в митохондриях. Окись азота подавляет синтез ДНК. Без синтазы окиси азота и аргинина защитная активность у макрофага отсутствует. Производные аргинина, особенно метильные, блокируют как образование нитратов в макрофагах, так и способность макрофагов разрушать опухолевые клетки.
В-лимфоциты
При взаимодействии опухолевого антигена и В-лимфоцита, рецептор которого соответствует данному антигену, происходит отбор реагирующих В-лимфоцитов. Они перерабатывают опухолевые антигены и активируются. У активированных В-лимфоцитов процессированный антиген представлен на плазматической мембране в комплексе с белком MHC класса II. Зрелая Т-хелперная клетка, прошедшая антигенспецифичную активацию макрофагом с белком MHC класса II, связывается с активированным В-лимфоцитом. Это приводит к выделению Т-хелпером интерлейкина-2, под действием которого В-клетка делится и дифференцируется, превращаясь в плазматическую клетку. Зрелая плазматическая клетка секретирует антигенспецифичные иммуноглобулины (антитела).
Опухольспецифичные антитела связываются с антигенами опухоли. Но опухолевая клетка имеет интересную особенность: она может терять свои поверхностные антигены, как ящерица отбрасывает хвост, когда за него её поймают.
Фоновый уровень комплемента у человека недостаточен для развития антителозависимого лизиса опухолевой клетки. Комплекс антиген-антитело покидает опухолевую клетку раньше, чем происходит активация и полимеризация комплемента.
Образующиеся противоопухолевые антитела и циркулирующие иммунные комплексы усугубляют развитие болезни. Они блокируют антигены опухолевых клеток и рецепторы Т-киллеров, защищая опухолевую клетку от цитолитического удара.
В структуре углеводов, как и в структуре нуклеиновых кислот и белков, заложена важная биологическая информация. Углеводы обладают самой высокой информационной ёмкостью, поскольку они характеризуются наибольшим потенциально возможным структурным разнообразием. Из двух идентичных моносахаридов могут образоваться одиннадцать различных дисахаридов, тогда как две аминокислоты могут давать лишь один дипептид. Считывание углеводных "слов" основано на вариабельности субъединиц сахаров, различиях в связях между ними, наличии или отсутствии точек ветвления. Так, набор углеводов раковых клеток резко отличается от такового нормальных клеток, и может служить маркёром опухоли. Поверхностные углеводы опухолевых клеток помогают метастазированию. Проникнув в кровеносное русло, опухолевая клетка путешествует по кровеносной системе, покинуть которую может только через стенку венулы. В венулах опухолевые клетки связываются с Е-селектинами (особыми поверхностными молекулами адгезии, которые взаимодействуют с поверхностными углеводами других клеток) эндотелиальных клеток, и между клетками эндотелия выходят из кровеносного русла. Таким путём опухолевая клетка попадает в другие органы и ткани, давая метастазы. Чтобы опухолевая клетка покинула кровоток, ей требуется 8-24 часа. Лишь 1 из 10000 клеток, оставивших первичную опухоль, выживает и даёт начало новой колонии. На своей поверхности опухолевые клетки имеют клеточные адгезивные молекулы (CAM, от англ. cell-adhesion molecules), при метастазировании прикрепляющиеся к CAM тех органов и тканей, с которыми они имеют наибольшее сходство. Чем больше в органе развита капиллярная сеть, тем чаще там бывают метастазы. Этим объясняется типичное метастазирование опухолей в определённые органы и ткани. CAM и иммуноглобулины имеют структурную гомологию (в процессе эволюции молекулы иммуноглобулинов произошли от CAM).
Некоторое значение при опухолевом росте имеют лектины (класс белков, способных быстро, избирательно и обратимо связываться с сахарами). Они, связавшись с поверхностными углеводами опухолевых клеток, являются фактором защиты опухоли от системы иммунитета. Если клетки меланомы обработать соединениями, содержащими лактозу, то их метастазирование ослабляется почти вдвое.
Вторичные опухоли метастазируют более легко, так как их сосудистая сеть, возникшая в результате самоиндуцированного ангиогенеза, легко проницаема.
Выяснение механизмов взаимодействия углеводных компонентов опухоли и системы иммунитета позволяет разрабатывать новые, эффективные средства предупреждения и лечения онкологических заболеваний.
В настоящее время известны гены и установлены аминокислотные последовательности более двух десятков интерлейкинов (IL-1...IL-22), играющих важную роль в формировании противоопухолевой защиты. При любом опухолевом росте имеются нарушения в системе интерлейкинов, которые проявляются дисбалансом продукции и регуляции этих биологически активных веществ, а также изменением экспрессии соответствующих рецепторов.
Интерлейкины продуцируются различными клетками организма и являются факторами взаимодействия между клетками всех органов и систем. Во многих случаях они проявляют себя как факторы аутокринной регуляции.

Рис. 6. Продукция цитокинов
Интерлейкин-1
Интерлейкин-1 (IL-1) участвует практически во всех этапах иммунного ответа. Активирует APC и CD4 лимфоциты, влияет на дифференцировку Т- и В-лимфоцитов и других иммунокомпетентных клеток. IL-1 активирует цитотоксические Т-лимфоциты и NK-клетки, участвует в регуляции продукции IL-2, IL-4, IL-6, IL-8, гранулоцит-макрофаг колониестимулирующего фактора (GM-CSF) и других цитокинов. Активными ингибиторами продукции IL-1 являются IL-4, IL-10, IL-12 и фактор некроза опухоли-альфа (TNF-a).
В зависимости от формы, IL-1 по-разному влияет на опухолевый рост. Имеются две формы этого интерлейкина: IL-1a и IL-1b. Они отличаются биологической активностью. IL-1a усиливает сниженный противоопухолевый иммунитет, замедляет рост опухоли и снижает её метастатический потенциал, повышает сопротивляемость бактериальной инфекции. На регенерацию тканей IL-1a не влияет. IL-1a быстро инактивируется при повышенной температуре тела. Простагландин Е2 (ПГЕ2) снижает противоопухолевый потенциал IL-1a.
IL-1b, наоборот, усиливает регенерацию тканей и стимулирует у онкологических больных развитие метастазов. Это происходит потому, что IL-1b усиливает продукциюПГЕ2, увеличивает экспрессию рецепторов маннозы на эндотелиальных клетках и продукцию фактора роста опухоли. Через 1 месяц после применения IL-1b у пациентов без метастазов отмечался рост опухолевых маркеров в 2-10 раз, а у пациентов с метастазами происходил рост опухолевых маркеров в 20-40 раз.
Предпринимаются попытки нейтрализации IL-1b при онкопатологии. Для этих целей используют моноклональные антитела или рекомбинантные растворимые рецепторы IL-1b (sIL-1bR), применяют блокаду рецепторов IL-1b рекомбинантными IL-1b антагонистами. Но относительно короткое время полужизни IL-1b антагониста in vivo и рекомбинантного растворимого рецептора IL-1b требует применения больших доз этих белков. Ведутся работы по созданию sIL-1bR-IgG объединённого белка, который длительно циркулирует в кровотоке и обеспечивает лучший терапевтический эффект. Введение антагонистов рецептора IL-1b (IL-1bRa) ингибирует развитие метастазов на 73-87%.
Интерлейкин-2
Интерлейкин-2 (IL-2) обладает выраженной способностью индуцировать активность практически всех клонов цитотоксических клеток. Он был первым интерлейкином, у которого была выявлена эта способность, и первым интерлейкином, применённым Стивеном А. Розенбергом и сотрудниками для иммунотерапии рака.
IL-2 повышает цитолитическую функцию Т-киллеров и NK-клеток, увеличивает продукцию этими клетками перфоринов и IFN-g,активирует моноциты и макрофаги, которые повышают синтез и секрецию TNF-a, IL-1b, IL-6, IL-8, гранулоцит-колониестимулирующего фактора (G-CSF), GM-CSF.
Введение IL-2 обеспечивает ускорение пролиферации Т- и В-лимфоцитов, нарастание иммунного ответа на Т-зависимый антиген, восстановление функционального резерва макрофагов. Положительный эффект при использовании низких доз IL-2 отмечен при лечении не-ходжкинских лимфом. При этом применяют длительную инфузию рекомбинантного IL-2 в сочетании с моноклональными антителами против CD19. IL-2 может вызвать продолжительную ремиссию острого миелоидного лейкоза (ОМЛ). При использовании IL-2 можно получить полную ремиссию у больных ОМЛ с низким уровнем остаточных бластов в костном мозге. В настоящее время в ряде клиник инфузии IL-2 применяются как укрепляющая терапия при вторичной ремиссии острого миелоидного лейкоза. IL-2 оказывает хороший эффект при пре- и постоперационном лечении злокачественной меланомы, почечной карциномы и сосудистой эндотелиальной саркомы. Внутриочаговое применение IL-2 при геманглиоэндотелиоме часто приводит к исчезновению опухоли.
Необходимо учитывать, что при использовании высоких доз IL-2 могут возникать серьезные гематологические нарушения, проявляющиеся анемией, нейтропенией, тромбоцитопенией и лимфоцитозом. Анемия обусловлена тем, что IL-2 снижает в костном мозге количество колоний ранних предшественников эритропоэза. Не исключено, что это действие IL-2 опосредуется IFN-γ , синтез которого индуцируется IL-2, т. к. антитела к IFN-γ прерывают снижение эритроидных колоний. Подобное влияние IL-2, опосредованное IFN-γ, прослеживается в отношении нейтрофилов. Лимфоцитоз обусловлен прямым митогенным эффектом IL-2 на клетки лимфоидного ряда.
При различных злокачественных новообразованиях человека может иметь место снижение продукции IL-2 лимфоцитами периферической крови, что нередко коррелирует со снижением активности киллерных клеток. Однако достоверное снижение продукции IL-2 выявляется на поздних, Ш и IVстадиях болезни при отсутствии достоверных изменений на ранних стадиях процесса.
Активность IL-2 зависит и от функционирования рецепторов IL-2 (IL-2R). Так, при глиобластоме отмечают селективный дефект продукции IL-2 и уменьшение экспрессии IL-2R на цитотоксических клетках. Мутация гена рецептора IL-2 отмечена в лимфоцитах больных карциномой желудка и раком прямой кишки. В результате параллельного изучения уровня продукции IL-2 и экспрессии IL-2R на Т-лимфоцитах больных глиобластомой в ответ на действие IL-2 было установлено, что снижение экспрессии IL-2R связано с низким уровнем тирозин-фосфорилирования в Т-лимфоцитах (при других опухолях мозга этого не наблюдалось).
Значительным препятствием на пути реализации противоопухолевых эффектов IL-2 и его продукции является появление высоких концентраций растворимой формы рецептора к IL-2 (sIL-2R). Физиологические концентрации sIL-2R у здоровых людей регулируют взаимодействие в цитокиновой сети. У больных раком значительное увеличение sIL-2R приводит к формированию иммуносупрессии. Высокий уровень sIL-2R обнаруживают в сыворотке крови и асцитической жидкости больных раком яичника. Аналогичное повышение уровня sIL-2R в сыворотке крови имеет место при меланоме, раке кишечника, легкого, почки, мочевого пузыря и прямо коррелирует с прогрессированием и метастазированием опухоли. Высокий уровень sIL-2R при злокачественных новообразованиях является маркёром плохого прогноза и агрессивности заболевания.
Установлено, что ингибирование IL-2 во многом связана с накоплением иммуносупрессивных субстанций, к которым в первую очередь относятся простагландины, иммунные комплексы, продукты жизнедеятельности опухолевых клеток, приводящих к развитию иммуносупрессии. Ганглиозиды, выделяемые клетками человеческой меланомы, угнетают продукцию IL-2 и оказывают прямое повреждающее действие на его молекулы.
Интерлейкин-3
Интерлейкин-3 (IL-3) является полипотентным активатором гемопоэтических клеток. Роль IL-3 в опухолевом росте пока изучена недостаточно. Возможно его участие в противоопухолевой защите через стимуляцию NK-клеток. У IL-3 имеется синергизм с IL-4 в индукции активности некоторых CD4+ лимфоцитов. IL-3 может усиливать опухолевую цитотоксичность Т-лимфоцитов.
Интерлейкин-4
Интерлейкин-4 (IL-4) участвует в дифференцировке Т-хелперов: Th-0 в Th-1 и Th-2. Под действием IL-4 происходит переключение В-лимфоцитов на синтез IgE. IL-4 осуществляет контроль за регуляцией продукции TNF-a, IL-1b, IL-5, IL-6, IL-8, усиливает дифференцировку в цитотоксические Т-клетки, активирует макрофаги, усиливая их цитотоксический потенциал, индуцирует пролиферацию NK-клеток и при определенных условиях может участвовать в генерации LAK-клеток. Основными продуцентами IL-4 являются CD4+ и CD8+ лимфоциты, В-лимфоциты и макрофаги.
В средних дозах IL-4 может быть синергистом с IL-2 в индукции LAK-клеток, полученных как из периферической крови, так и лимфоцитов, инфильтрирующих опухоль. IL-4 как в низких, так и в высоких дозах ингибирует продукцию IL-2 лимфоцитами и IL-2-индуцированную цитотоксичность LAK-клеток, снижает экспрессию рецептора к IL-2.
IL-4 ингибирует in vitro рост злокачественных клеток больных острым Ph-позитивным лимфолейкозом (Ph-филадельфийская хромосома), в то время как на Ph-негативный острый лейкоз IL-4 не влияет. IL-4 подавляет рост злокачественных клеток у больных хроническим миеломоноцитарным лейкозом, имеет значительный противоопухолевый эффект при хроническом миелоцитарном лейкозе (ХМЛ) и остром миелоцитарном лейкозе (ОМЛ), но не влияет на хронический лимфолейкоз (ХЛЛ) Ph-позитивный в период бластного криза.
Интерлейкин-5
Интерлейкин-5 (IL-5) преимущественно регулирует процессы пролиферации и дифференцировки эозинофилов, а также базофилов. Под действием IL-5 происходит переключение В-лимфоцитов на синтез IgA. IL-5 принадлежит существенное место в аллергическом воспалении.
Противоопухолевая активность IL-5 связана с его способностью участвовать в апоптозе, что показано в опытах с IL-5-чувствительной эритролейкемической линией TF-1, а так же со способностью индуцировать активность эозинофилов, которые повреждают опухолевые клетки путем выделения катионного и большого основного протеинов.
Интерлейкин-6
Интерлейкин-6 (IL-6) регулирует дифференцировку В-лимфоцитов и усиливает антителообразование, индуцирует цитотоксичность клеток, не зависимую от экспрессии антигенов MHC, в том числе и их ответ на IL-2 и IFN-g. Наряду с выраженными провоспалительными действиями он модулирует противоопухолевую активность макрофагов. IL-6 принимает участие в генерации LAK-клеток и защищает нейтрофилы от апоптоза, усиливая их цитотоксический потенциал в отношении опухолевых клеток. IL-6 усиливает синтез С-реактивного белка (СРБ). Имея пентамерную форму, СРБ, после связывания с фосфолипидами опухолевой клетки, активирует C1q субкомпонент системы комплемента, запуская процесс, аналогичный классическому пути активации комплемента, что приводит к формированию мембраноатакующего комплекса и в некоторых случаях может приводить к лизису опухолевой клетки. Ингибирование роста опухоли IL-6 может быть связано и с его способностью индуцировать секрецию антагониста рецептора IL-1b. IL-6 может индуцировать регрессию опухоли только на ранних этапах роста слабоиммуногенных опухолей, но не оказывает такого эффекта на рост иммуногенных опухолей на поздних этапах их развития. В подавляющем большинстве случаев опухолевая прогрессия сопровождается увеличением уровня IL-1b, IL-6 и белков острой фазы при опухолях головы, шеи, гортани, желудка, печени, поджелудочной железы, кишечника, почек, яичника. Прогрессия опухолевого роста связана с усилением антителообразования под действием IL-6. Образующиеся противоопухолевые антитела блокируют антигены опухолевых клеток и рецепторы Т-киллеров, защищая опухолевую клетку от разрушения.
Антитела к IL-6 замедляют рост опухоли. Кроме противоопухолевого эффекта, воздействие антител к IL-6 приводит к снижению уровня СРБ и нормализации нейтропении и тромбоцитопении у пациентов миеломоноцитарным лейкозом, хотя у пациентов с очень высоким уровнем IL-6 в сыворотке крови ответ на используемые дозы антител к IL-6 отсутствует.
IL-6 вместе с IL-1b принимает участие в патогенезе анорексии, кахексии и анемии у онкологических больных. Усиление синтеза СРБ под действием IL-6 способствует прогрессированию атеросклероза у больных с данной патологией. Блокирование гена IL-6 или введение антител против IL-6 приводит к заметному снижению выраженности анорексии, кахексии и анемии.
Интерлейкин-7
Интерлейкин-7 (IL-7) известен как ростовой фактор незрелых В- и Т- и зрелых Т-лимфоцитов. IL-7 генерирует опухольспецифические Т-киллеры различной локализации, участвует в генерации LAK-клеток, проявляя себя как синергист IL-2. Для индукции LAK-клеток с помощью IL-7 необходимо более длительное культивирование, чем с IL-2, но IL-7-индуцированные LAK-клетки эффективнее в своей цитотоксичности и сохраняют её на протяжении большего периода, лизируя опухолевые клетки широкого спектра. IL-7 регулирует экспрессию гена IL-2 у активированных Т-лимфоцитов, поэтому снижение продукции этого интерлейкина может отрицательно влиять и на продукцию IL-2. IL-7 может индуцировать апоптоз опухолевых клеток, вызывает дифференцировку клеток подгруппы острого миелобластного лейкоза.
Интерлейкин-8
Интерлейкин-8 (IL-8) продуцируется многими типами клеток и обладает выраженными провоспалительными свойствами. Основным биологическим эффектом IL-8 является индукция хемотаксиса нейтрофилов, эозинофилов, базофилов и других клеток системы иммунитета. IL-8 усиливает ангиогенез in vivo и in vitro. Роль IL-8 при опухолевом росте пока не изучена.
Интерлейкин-9
Интерлейкин-9 (IL-9) стимулирует выделение IL-2, IL-4, IL-6, IL-11, IFN-g, IL-9, принимает участие в стимуляции цитотоксичности Т-киллеров и NK-клеток, индукции апоптоза. Роль IL-9 при опухолевом росте пока недостаточно изучена.
Интерлейкин-10
Интерлекин-10 (IL-10) продуцируется Th-1 и Th-2, моноцитами, макрофагами и имеет широкий спектр действия с выраженным иммуносупрессорным эффектом. IL-10 снижает активность Th-1 в большей степени, чем Th-2. Противовоспалительная активность IL-10 проявляется способностью снижать продукцию провоспалительных цитокинов, усиливать продукцию антагониста рецептора IL-1 и уменьшать адгезию лейкоцитов к эндотелиальным клеткам, активированным IL-1. IL-10 может стимулировать синтез IgE. В своем ингибирующем действии на клеточный иммунитет IL-10 синергичен с IL-4.
При различных опухолях отмечено повышение уровня IL-10 и снижение активности Т-киллеров, экспрессии антигенов MHC, снижение продукции IL-12 и IFN-g, ослабление процесса презентации опухольассоциированных антигенов. Повышение уровня продукции IL-10 является плохим прогностическим признаком и сочетается с выраженной прогрессией опухолевого роста.
IL-10 может оказывать ингибирующий эффект на рост некоторых опухолей. Так, гистологическое исследование регрессирующей после введения IL-10 меланомы В 16 выявило отсутствие инфильтрации опухоли CD4+ и CD8+ лимфоцитами при активной инфильтрации NK-клетками. Эти данные до некоторой степени могут объяснить различную оценку роли IL-10 в опухолевом процессе.
IL-10 имеет обратное воздействие на злокачественные и незлокачественные клетки. С одной стороны, IL-10 предотвращает апоптоз В-клеток зародышевых центров лимфоузлов через индукцию bcl-2 белка, но с другой стороны IL-10 индуцирует апоптоз и ингибирование пролиферации В-клеток при ХЛЛ.
Интерлейкин-11
Интерлейкин-11 (IL-11) – провоспалительный интерлейкин, который регулирует функции Т- и В-лимфоцитов, принимает участие в индукции активности ряда киллерных клеток, является аутокринным фактором для пролиферации мегакариоцитов. Подобно IL-1 и IL-6 принимает участие в индукции синтеза белков острой фазы. Роль IL-11 при опухолевом росте изучена слабо.
Интерлейкин-12
Интерлейкин-12 (IL-12) – полипотентный активатор клеточного иммунитета с противоопухолевой и антиметастатической активностью. Он усиливает активность Т-киллеров, NK- и LAK-клеток. IL-12 активирует и цитотоксичность макрофагов, а дефицит его продукции макрофагами может значительно снижать противоопухолевую активность. IL-12 оказывает противоопухолевый эффект при раке легкого. Усиление роста опухоли, в частности, рака прямой кишки, ассоциируется со снижением продукции IL-12 и усилением продукции IL-10. Важным свойством IL-12 является усиление экспрессии FasL и индукция апоптоза. Рекомбинантный IL-12 способен препятствовать метастазированию в легкие и лимфатические узлы. Максимальный противоопухолевый эффект IL-12 наблюдается в сочетании с действием IL-2 и IFN-g.
IL-12 ингибирует ангиогенез. Антиангиогенное действие IL-12 реализуется на уровне рецепторов протеинкиназ, адгезивных молекул, интегринов и других поверхностных структур, усиления продукции IFN-g.
IL-12 замедляет у онкологических больных развитие кахексии и анемии, индуцированной IL-1b и IL-6 .
Интерлейкин-13
Интерлейкин-13 (IL-13) проявляет выраженную активность в отношении моноцитов и В-лимфоцитов. Индуцирует процессы фосфорилирования. Обладает сходством многих биологических эффектов с IL-4, рецептор IL-13 может быть субъединицей рецептора IL-4. Аффинитет связывания IL-4 и IL-13 с одними и теми же клетками зависит от того, с каким количеством изоформ рецептора происходит связывание. IL-13 не действует на Т-лимфоциты.
IL-13 ингибирует пролиферацию лейкемических пре-В-клеток.
Интерлейкин-14
Интерлейкин-14 (IL-14) является фактором роста B-лимфоцитов. Гиперпродукция этого интерлейкина способствует прогрессированию B-клеточной не-ходжкинской лимфомы. Антитела к IL-14 замедляют рост B-клеточной не-ходжкинской лимфомы.
Интерлейкин-15
Интерлейкин-15 (IL-15) по своим биологическим свойствам очень сходен с IL-2 и во многом является его синергистом, в частности, при индукции активности LAK-клеток. IL-15 усиливает противоопухолевую активность Т-киллеров и NK-клеток, продукцию цитокинов CD4+ лимфоцитами и может проявлять себя как хемоатрактант для Т-лимфоцитов. Продукция эндогенного IL-15 является одним из ключевых условий для синтеза IFN-g.
На цитотоксических Т-лимфоцитах и NK-клетках экспрессируются рецепторы семейства MHC 1 класса, которые ингибируют их киллерную активность - киллинг-ингибирующие рецепторы (KIR). IL-15 способен влиять на экспрессию KIR.
Интерлейкин-16
Интерлейкин-16 (IL-16) является Т-клеточным хемоатрактантом. Основные продуценты IL-16 – моноциты, CD8+ и B-лимфоциты. Этот интерлейкин усиливает подвижность CD4+ лимфоцитов и в содружестве с IL-2 способствует их активации. У пациентов с III и IV стадией рака молочной железы, кишечника, почки, мочевого пузыря, матки, яичника в сыворотке крови обнаруживают повышенный уровень IL-16.
Интерферон-альфа (IFN-a), гистамин и серотонин усиливают продукцию IL-16.
Интерлейкин-17
Интерлейкин-17 (IL-17) продуцируется преимущественно CD4+ лимфоцитами и стимулирует гранулоцитопоэз, усиливая образование гранулоцит-колониестимулирующего фактора (G-CSF). IL-17 принимает участие в регуляции активности многих цитокинов - IL-1, IL-4, IL-6, IL-10, IL-12, IFN-g.
IL-17 может приводить к усилению антителозависимой гибели опухолевых клеток. Гистамин и серотонин усиливают продукцию IL-17.
Интерлейкин-18
Интерлейкин-18 (IL-18) является синергистом некоторых эффектов IL-12, особенно в индукции выработки IFN-g и ингибировании ангиогенеза. Выраженное усиление продукции IFN-g под влиянием комплексного воздействия IL-18 и IL-12 способствует подавлению опухолевого роста.
Интерлейкин-19
Интерлейкин-19 (IL-19) продуцируется преимущественно моноцитами и по своей биологической функции подобен IL-10. Липополисохариды (LPS) стимулируют синтез этого интерлейкина. Самым сильным стимулятором IL-19 является GM-CSF. IL-19 регулирует функции макрофагов, понижает активность Th-1 и Th-2.
IL-19 усиливает синтез bcl-2 белка и таким образом влияет на апоптоз как опухолевых клеток, так и клеток системы иммунитета.
Интерлейкин-20
Интерлейкин-20 (IL-20) секретируется преимущественно кератиноцитами и играет важную роль в реакциях воспаления кожи. Синтез IL-20 повышен при псориазе. По своей биологической активности IL-20 имеет сходство с IL-10 и может стимулировать рост опухолей кожи.
Интерлейкин-21
Интерлейкин-21 (IL-21) выполняет важную роль в регуляции гемопоэза и в иммунном ответе, влияет на развитие лимфоцитов. В противоопухолевой защите он по своей биологической активности наиболее близок к IL-2 и IL-15. IL-21 способствует быстрому увеличению T-лимфоцитов, вызывает быстрое увеличение и созревание NK-клеток, а так же быстрое увеличение популяции зрелых B-лимфоцитов.
Интерлейкин-22
Интерлейкин-22 (IL-22) продуцируется активированными T-лимфоцитами в острую стадию воспаления. По своей биологической активности отдаленно напоминает IL-10, но в отличие от IL-10, IL-22 не запрещает производство провоспалительных цитокинов моноцитами в ответ на LPS. Кроме того, по своей биологической активности IL-22 отдаленно напоминает интерфероны a, b и g. Роль IL-22 в противоопухолевой защите пока не установлена.
Влияние интерлейкинов на опухолевый рост многогранно, поэтому к иммунотерапии опухолей с использованием интерлейкинов необходимо подходить с глубоким знанием исходного уровня интерлейкинов и механизмов сложного взаимодействия каждого интерлейкина с конкретной опухолью и клетками системы иммунитета.
Следует иметь ввиду, что при применении высоких доз интерлейкинов развиваются побочные реакции, которые могут проявляться в виде озноба, тошноты и рвоты, гипербилирубинемии, олигурии, повышения уровня креатинина, дезориентации, снижения давления. Образование антител против рекомбинантных интерлейкинов значительно снижает эффективность их применения.
В организме здорового человека клеточный гомеостаз определяется балансом между гибелью и пролиферацией клеток. Апоптоз – программированная клеточная гибель, энергетически зависимый, генетически контролируемый процесс, который запускается специфическими сигналами и избавляет организм от ослабленных, ненужных или повреждённых клеток. Ежедневно примерно около 5% клеток организма подвергаются апоптозу, а их место занимают новые клетки. В процессе апоптоза клетка исчезает бесследно в течение 15-120 минут. TNF-a и Fas-лиганд (CD178) запускают каскад биохимических реакций, финальным этапом которых является дефрагментация хромосом и гибель клетки. На поверхности клеток организма имеются специальные рецепторы для TNF-a: TNF-RI (с молекулярной массой 55-60 кДа) и TNF-RII (с молекулярной массой 75-80 кДа), а для Fas-лиганда рецептор Fas/APO-1 (CD95).
TNF-R и Fas/APO-1(CD95) имеют гомологию в экстрацеллюлярных доменах, представленную в виде богатых цистеином доменов, и гомологичную последовательность в интрацеллюлярной части рецептора.
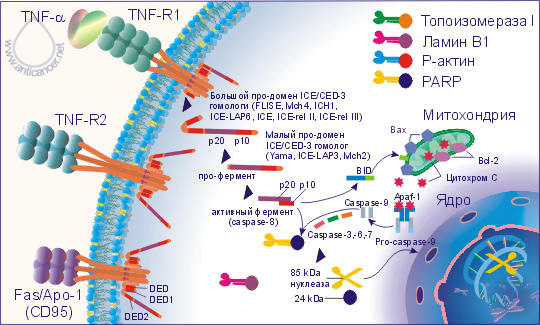
Рис. 7. Апоптоз
Связывание TNF-a и Fas-лигандов с рецепторами апоптоза активирует интрацеллюлярные "домены смерти" (DED - death effector domain) этих рецепторов: DED, DED1 и DED2 и ряд посредников, включая церамиды, ras, SAPK/JNK, протеиновые тирозинкиназы, катепсин D и протеазы ICE/CED-3 семейства, которые каскадно проводят смертельный сигнал. Цистеиновые протеазы ICE/CED-3 семейства находятся в составе интрацеллюлярной части рецептора апоптоза в неактивной форме, они относятся к интерлейкин-lb расщепляющим ферментам (ICE). Это семейство включает ряд различных типов протеаз, многие протеазы имеют несколько обозначений. Семейство цистеин-аспартат протеаз ещё называют каспазами.
Известно 14 каспаз:
Caspase-1 (ICE)
Caspase-2 (Ich-1, Nedd2)
Caspase-3 (CPP32, Yama, Apopain, SCA-1, LICE)
Caspase-4 (ICEreI-II, TX, ICH-2)
Caspase-5 (ICErel-III, TY)
Caspase-6 (Mch-2)
Caspase-7 (Mch-3, ICE-LAP-3, CMH-1)
Caspase-8 (FLICE, Mach-1, Mch5)
Caspase-9 (ICE-LAP6, Mch6, Apaf-3)
Caspase-10 (FLICE-2, Mch4)
Caspase-11
Caspase-12
Caspase-13 (ERICE)
Caspase-14 (Mini-ICE)
Кроме семейства каспаз, в регуляции апоптоза принимает участие семейство Bcl-2 белков, в котором Bcl-2, Bcl-XL, Ced-9, Bcl-w и Mcl-1 белки ингибируют апоптоз, а Bcl-2 гомологи (BH) 1-3, Bax подобный белок, Bak, Bok, и состоящие только из BH3 региона, Bad подобный белок, Bid, Bik, Bim, и Hrk выполняют проапоптозную функцию.
Активация DED, DED1 и DED2 вызывает каскадную перестройку и активацию протеаз ICE/CED-3 семейства. Первым этапом является превращение неактивной про-каспазы-8 в активную каспазу-8. Каспаза-8 активирует каспазу-3 и Bid. Bid, взаимодействуя с Bax, способствует выходу из митохондрий цитохрома C, который активизирует каспазу-9. В свою очередь, активная каспаза-9 приводит к появлению активных каспаз-3, -6, -7. Далее активные ICE начинают взаимодействовать с рядом внутриклеточных субстратов: поли-(АДФ-рибозо)полимеразой (PARP), участвующей в репарации ДНК и модификации активности некоторых ядерных белков, ламином В1, топоизомеразой I и Р-актином. Все члены семейства ICE/CED-3 протеаз содержат каталитический остаток цистеина и расщепляют субстраты после аспарагиновой кислоты. Специфическое расщепление PARP, ламина В1, топоизомеразы I и Р-актина под действием ICE-подобных протеаз на большие и малые фрагменты приводит клетку к гибели, т. к. большие фрагменты этих субстратов и являются активными нуклеазами, которые разрезают хромосомы на фрагменты. Например, PARP расщепляется CPP32/Yama на два фрагмента - 85 и 24 кДа, из которых апоптоз-специфическим является фрагмент 85 кДа. Активация протеаз ICE/CED-3 семейства может происходить и под действием фосфолипидов, например, церамидов, которые способны активировать CPP32/Yama.

Рис. 8. Церамиды
Свободный сфингозин, образуемый из церамидов в результате его гидролиза церамидазой, так же активирует ICE-подобные протеазы и ускоряет апоптоз.


Рис. 9. Сфингозины
Важная роль в осуществлении апоптоза принадлежит тироксину (Т4).
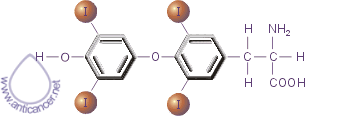
Рис. 10. Тироксин
Он регулирует функционирование протеиновой тирозинкиназы, важного элемента реализации сигнала смерти. При недостатке этого гормона щитовидной железы происходит подавление апоптоза.
IL-lb блокирует апоптоз. ICE-подобные протеазы взаимодействуют с IL-lb, а не с PARP, ламином В1, топоизомеразой I и Р-актином, в результате чего не происходит образования активных нуклеаз, и клетка избегает апоптоза.
На взаимодействие TNF-a и Fas-лигандов с TNF-R и Fas/APO-1(CD95) и проведение апоптотического сигнала оказывают влияние Bcl и Bax белки. Так, белки Bcl семейств Bcl-2, Bcl-xL и Bcl-xS блокируют выход цитохрома С из митохондрий и таким образом предотвращают превращение про-каспазы-9 в активную форму, отменяя апоптотический сигнал. В свою очередь, Bax белки способствуют выходу цитохрома С из митохондрий и образованию активной каспазы-9, которая инициирует продолжение и активацию апоптотическог каскада, начавшегося с присоединения TNF-a или Fas-лигандов к TNF-R и Fas/APO-1(CD95). Быть или не быть апоптозу, зависит от соотношения Bcl и Bax белков в митохондриях. Преобладание экспрессии белков Bcl семейства блокирует запуск апоптоза, а преобладание экспрессии Bax белков способствует реализации сигнала смерти.
Все эти особенности необходимо учитывать при проведении противоопухолевой терапии. Понимание механизмов апоптоза помогает правильно выбирать элементы комплексной иммунотерапии опухолей, разрабатывать новые средства лечения смертельно опасной болезнь. Например, применение TNF-a будет неэффективным у тех пациентов, которые имеют высокий уровень Bcl-2 и/или IL-lb. Мероприятия, направленные на повышение экспрессии Bax белков и уменьшения уровня Bcl-2 и/или IL-lb, будут повышать эффективность TNF-a терапии.
В основе жизни лежит деление клеток организма. Вся информация о человеке хранится в хромосомах, основными элементами которых являются дезоксирибонуклеиновые кислоты (ДНК). Высокополимерные ДНК в комплексе с молекулами многочисленных белков и составляют хромосому.
В 1932 году генетик, Нобелевский лауреат Герман Мёллер обратил внимание на особое поведение концевых участков хромосом, которые предотвращали склеивание одних хромосом с другими. Он назвал их "теломерами", что в переводе с греческого означает "концевые частички".
Для деления клетки необходимо, чтобы перед этим произошло удвоение хромосом при помощи фермента ДНК-полимеразы (синтезирующего копию ДНК). Все известные ДНК-полимеразы ведут синтез в направлении от 5' к 3' концу и при этом нуждаются в одноцепочечной ДНК-матрице и 3'-ОН конце праймера (начальном месте прикрепления фермента к нуклеотидной цепи). Функцию праймера выполняет РНК, образуемая ферментом репликативного комплекса – праймазой. После завершения синтеза копий ДНК происходит удаление РНК-праймеров, и дочерние цепи ДНК оказываются недореплицированными, то есть короче материнских на размер РНК-праймера (100-200 нуклеотидов), чем и обусловлено старение организма.
Прогрессивное укорочение теломер является счетно-ограничительным механизмом митотических циклов и играет роль часов, отсчитывающих число делений клетки и продолжительность жизни. При каждом делении теломеры дочерних клеток становятся короче на 100-200 нуклеотидов.
По достижении критической длины теломерной ДНК запускаются процессы остановки клеточного цикла. В 1965 году это впервые установил американский ученый Л. Хейфлик из Института Вистар в Филадельфии. Фибробласты и эпителиальные клетки человека, в культурах in vitro, после 50-60 делений (так называемое "число Хейфлика") необратимо останавливались в G1- или G2-фазах клеточного цикла. Это состояние получило название сенессенса или "репликативного старения", оно обусловлено исчезновением теломер и образованием "липких" концов хромосом, что вызывает их соединение и запуск реакций разрушения ДНК, в результате чего клетка утрачивает способность к репродукции и погибает.
В организме здорового человека есть клетки, которые могут делиться бесконечное количество раз и не подвержены старению. Это стволовые клетки, активированные лимфоциты, базальные клетки эпидермиса, мужские и женские половые клетки. В них активна теломераза, которая восстанавливает первоначальную длину теломер. Такие клетки способны к бесконечному делению. Элонгация (восстановление) теломерных повторов ДНК в клетках с активной теломеразой приводит к отмене ограничений на число делений, и такие клетки приобретают бессмертие. Это явление называется «иммортализация».
При злокачественном перерождении клеток также происходит отмена ограничений на число делений клетки, благодаря активации гена теломеразы, и эти клетки становятся бессмертными. Сочетание активной теломеразы и угнетение апоптоза в опухолевой клетке приводит к трагическим последствиям для организма, который погибает от безудержного роста злокачественной опухоли.
Теломераза – фермент, состоящий из белковой части и РНК, – был обнаружен Грейдером и Блэкберном в 1985 году. У человека hTERT (Homo sapiens telomerase reverse transcriptase) достраивает недореплицированные 3'-концы теломер ДНК короткими повторяющимися последовательностями TTAGGG. Главной функцией теломер является защита концов хромосом от деградации и слипания во время клеточного деления. Длина теломер колеблется от 5 до 15 тысяч пар оснований. Именно выступающие 3'-концы материнских хромосом узнаются теломеразой, которая последовательно наращивает материнские цепи на сотни повторов, используя их 3'-ОН концы в качестве праймеров, а РНК, входящую в состав фермента, в качестве матрицы. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом

Рис. 11. Восстановление теломер под влиянием теломеразы
Ведутся работы по блокированию гена теломеразы в опухолевых клетках. Решение этой сложной, но вполне достижимой задачи позволит значительно продлить жизнь онкологическим больным.
Благодаря разуму человека созданы тысячи веществ, вызывающих опухоли, благодаря разуму - выяснены многие механизмы опухолевого роста. Глубокое понимание взаимодействия системы иммунитета и опухоли позволяет уже сегодня избрать оптимальный вариант лечения рака и существенно продлить или спасти жизнь многим больным.